题目内容
【题目】2008年北京奥运会火炬使用丙烷作燃料。丙烷属于( )
A. 无机物 B. 有机物 C. 氧化物 D. 混合物
【答案】B
【解析】
丙烷是烷烃,烷烃即饱和烃,是只有碳碳单键和碳氢键的链烃,是最简单的一类有机化合物。
丙烷分子式为C3H8,只含有碳、氢两种元素,属于烷烃,故选B。

 新课标阶梯阅读训练系列答案
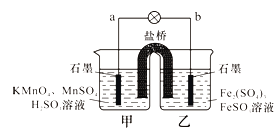
新课标阶梯阅读训练系列答案【题目】硫代硫酸钠(Na2S2O3)商品名“海波”,俗名“大苏打”,分析化学上常用于 滴定实验。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。

I.制备 Na2S2O3
(1)如图,关闭K1打开K2, 反应开始后,装置c中的产物除 了 Na2S2O3外还有一种无色无味 的气体,这种气体是______。
(2)装置c中反应结束后, 先关闭分液漏斗旋塞,在e处连 接盛NaOH溶液的注射器,再关闭K2打开K1 ,其目的是_______________。待c中溶液冷却后,倒入蒸发皿,通过加热蒸发、冷却结晶和干燥等操作获得Na2S2O3 CH2O晶体。
(3)实验结束后,装置d中的溶质可能有__________________。
探究Na2S2O3的部分化学性质
【分析推理】Na2S2O3可以看成是一个S原子取代了 Na2SO4中一个O原子形成的。据此 推测,下列说法正确的是____________。
A.![]() 和
和![]() 都是正四面体结构 B.
都是正四面体结构 B.![]() 中硫硫键的键长大于硫氧键
中硫硫键的键长大于硫氧键
C.![]() 中的键角均为
中的键角均为![]() D.
D.![]() 中所有原子都满足8电子结构
中所有原子都满足8电子结构
【提出假设】①Na2S2O3与Na2SO4结构相似,化学性质也应该相似,因此室温时Na2S2O3 溶液pH=7。②从S元素的化合价推测Na2S2O3具有较强的还原性。
【验证假设】配制适量Na2S2O3溶液,进行如下实验(请填空):
实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
① | ___________________ | 溶液pH=8 | ___________ |
② | 向新制氯水中滴入适量Na2S2O3溶液 | 氯水褪色 | _____________ |
【实验结论】__________________
【题目】部分弱酸的电离平衡常数如表。
弱酸 | HCOOH | H2S | H2SO3 |
电离平衡常数 (25℃) | K=1.8×10-4 | K1=9.1×10-8 K2=1.1×10-12 | K1=1.23×10-2 K2=6.6×10-8 |
(1)物质的量均为0.1mol/L的溶液①HCOONa②NaHS③Na2SO3,pH最大的是________(填编号)
(2)设计实验证明HCOOH为弱酸
(3)室温下,下列溶液中水电离出的c(H+)水由大到小的顺序为________(填编号)
①pH=12的NaOH溶液 ②NaCl溶液 ③pH=6的NH4Cl溶液 ④0.01mol/L醋酸
(4)二元酸H2A在水中存在以下电离:H2A=H++HA-,HA-![]() H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
①NaHA溶液呈 (填“酸性”、“碱性”、“中性” )
②某温度下,10mL、0.1mol/LNaHA溶液中加入0.1mol/LKOH溶液VmL至中性,此时溶液中以下关系一定正确的是( )
A.溶液的pH=7 B.Kw=c2(OH-) C.V=10 D.c(K+)< c(Na+)
(5)如图横坐标为室温下溶液的pH,纵坐标为金属离子物质的量浓度的对数(当溶液中金属离子浓度≤10-5mol/L时,可认为沉淀完全)。试回答:
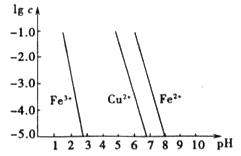
腐蚀铜板的溶液中,若Cu2+、Fe3+、Fe2+浓度均为0.1mol/L,向混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。
从图中的数据计算可得Fe(OH)2溶度积Ksp[Fe(OH)2]= 。