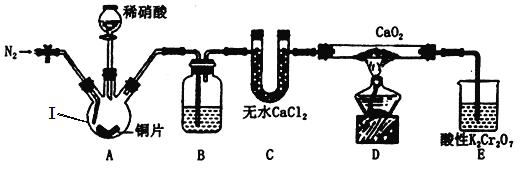
题目内容
【题目】已知有如右图所示转化关系(反应条件略)。
已知;①X、Y、Z、W均为氧化物。常温下,X是红棕色气体;Y能使澄清石灰水变浑浊但不能使品红溶液褪色。②相对分子质量:甲<乙。③将甲的浓溶液露置在空气中一段时间,质量减小浓度降低;将乙的浓溶液露置在空气中一段时间,质量增加浓度降低。请完成下列空白:

(1)Z是(写化学式):______________。
(2)将乙的浓溶液露置在空气中一段时间,质量增加浓度降低,表明乙的浓溶液具有__________性。利用这种性质可以进行__________项(填字母)实验操作。
A.钝化铁片 B.检验Ba2+ C.干燥氨气 D.干燥氯气
(3)在X与Z的反应中,被氧化的X与被还原的X的物质的量之比是________________。
(4)W可用于工业制溴过程中吸收潮湿空气中的Br2,写出该反应的离子方程式:______________。该反应很好地解决了环保问题,但给工业生产带来了_______________的问题。
(5)写出M与甲的浓溶液在加热条件下反应的化学方程式:______________。
【答案】 (1)H2O (2)吸水 D (3)2∶1
(4)SO2+Br2+2H2O=2HBr+H2SO4 强酸对设备腐蚀
(5) C+4HNO3(浓)=CO2↑+4NO2↑+2H2O
【解析】
试题X、Y、Z、W均为氧化物,常态下,X是红棕色气体,则X为NO2;Y能使澄清石灰水变浑浊但不能使品红溶液褪色,则Y为CO2;甲与M反应得到二氧化氮、二氧化碳,可推知甲为HNO3、M为碳,乙与碳反应得到二氧化碳、二氧化硫,可推知乙为H2SO4,故Z为H2O;
(1)由上述分析可知,Z为H2O。
(2)浓硫酸具有吸水性,露置在空气中一段时间,其质量增加浓度降低,可以用于干燥氯气。
(3)X和Z的反应为3NO2+H2O=2HNO3+NO,被氧化的二氧化氮生成HNO3,被还有的二氧化氮生成NO,由方程式可知,被氧化的NO2与被还原的NO2的物质的量之比是2:1。
(4)溴具有强氧化性,在溶液中奖二氧化硫氧化为硫酸,自身被还原为HBr,反应方程式为:SO2+Br2+2H2O=H2SO4+2HBr,由于生成强酸,在工业生产带来了强酸对设备腐蚀问题。
(5)碳与浓硫酸在加热条件下生成二氧化碳、二氧化氮与水,反应方程式为:C+4HNO3(浓)=CO2↑+4NO2↑+2H2O。