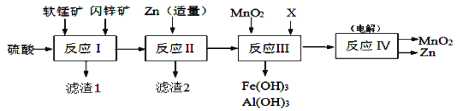
题目内容
【题目】我国要求在全国范围内形成全民节能减排氛围。下列有关做法中不符合这一要求的是( )
A、将煤液化、气化,提高燃料的燃烧效率
B、在汽车上安装汽车尾气催化转化装置,使之发生反应:
2CO+2NO![]() 2CO2+N2
2CO2+N2
C、在大力推广乙醇汽油的同时,研究开发太阳能汽车和氢氧燃料电池汽车
D、在水力发电、火力发电、核能发电和风力发电中,要大力发展火力发电
【答案】D
【解析】
试题分析:A选项正确,煤液化、气化属于化学变化,可以增大与空气的接触面,从而提高燃料的燃烧效率;B选项正确,在汽车上安装汽车尾气催化转化装置,使之发生反应,将氮的氧化物等污染气体转化为无污染的物质;C选项正确,乙醇汽油、太阳能、氢氧燃料电池的使用均无污染;D选项错误,火力发电,利用煤、石油、天然气等固体、液体、气体燃料燃烧时产生的热能,煤、石油的使用均污染环境不符合节能减排氛围;故选D。

【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D
【题目】下列实验方案、现象、得出的结论均正确的是
选项 | 实验及现象 | 结论 |
A | 向SiO2固体加入过量盐酸振荡,固体不溶解 | SiO2不溶于任何酸 |
B | 用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰 | 该样品含钠元素 |
C | 向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀 | 白色沉淀为BaSO3 |
D | 将镁条点燃,迅速伸入集满CO2的集气瓶有白色固体和黑色颗粒产生 | CO2具有氧化性 |
A. A B. B C. C D. D