题目内容
【题目】为了探究HCl、H2CO3和H2SiO3的酸性强弱,某学生设计了如图所示的实验装置,一次实验即可达到实验目的(不必选用其他酸性物质)请回答下列问题:
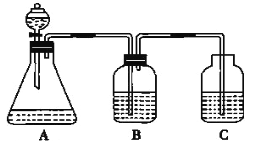
(1)锥形瓶中装有某种可溶性正盐溶液,则分液漏斗中所盛试剂应为_______。
(2)装置B中所盛的试剂是_______,其作用是_______。
(3)装置C中所盛的试剂是_______,C中所发生反应的离子方程式为_______。
(4)由此得出HCl、H2CO3、H2SiO3的酸性强弱顺序是____________。
【答案】盐酸碳酸氢钠溶液除去CO2中混有的HCl硅酸钠溶液CO2+H2O+SiO32-=CO32-+H2SiO3↓HCl>H2CO3>H2SiO3
【解析】
(1)根据较强酸制取较弱酸的原则,分液漏斗中应盛放三种酸中最强的酸,最强的酸是盐酸,所以分液漏斗中所盛试剂名称是盐酸;
(2)盐酸有挥发性,导致生成的二氧化碳气体中含有HCl气体,会对实验造成干扰,所以B装置要盛放能除去HCl气体,且不引入新的杂质、不能和二氧化碳反应的药品,一般常用饱和碳酸氢钠溶液,该试剂的作用是除去二氧化碳中的HCl气体杂质;
(3)硅酸钠能和二氧化碳、水反应生成硅酸和碳酸钠,反应的离子方程式为CO2+H2O+SiO32-=CO32-+H2SiO3↓;
(4)根据以上分析可知盐酸、碳酸、硅酸的酸性强弱顺序是HCl>H2CO3>H2SiO3。

【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D
【题目】煤化工中常需研究不同温度下的平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
CO2(g)+H2(g)的平衡常数随温度的变化如下,试回答下列问题:
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
(1)该反应的平衡常数表达式K=__________。该反应的正反应是______反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,恒容、升高温度,原化学平衡向______反应方向移动(填“正”或“逆”),容器内混合气体的压强________(填“增大”、“减小”或“不变”)。
(3)能判断该反应是否达到化学平衡状态的依据是(_____)
a.容器中压强不变b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)830℃,在恒容反应器中发生如表中的反应,按表中的物质的量投入反应混合物,其中向正反应方向进行的有__________(选填A、B、C、D)
n(CO) | n(H2O) | n(H2) | n(CO2) | |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 3 | 3 | 0 | 0 |
D | 0. | 2 | 1 | 1 |
【题目】下列装置所示的实验中,不能达到实验目的是
|
|
|
|
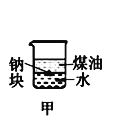
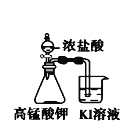
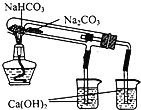
A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)< ρ(钠) < ρ(水) | C.探究氧化性: KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3的热稳定性 |
A. A B. B C. C D. D