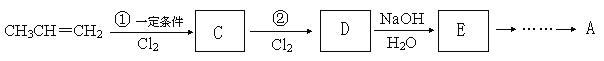
题目内容
【题目】按要求回答下列问题:
(1)氯气与氢氧化钠在70℃时反应,生成物中NaClO3和NaClO的物质的量之比为3︰1的离子方程
式
(2)①SO2通入足量Fe(NO3) 3稀溶液中,溶液由棕色变为浅绿色;②随着反应的进行上述溶液立即又变为棕黄色,液面上有无色气体产生到试管口为红棕色②的离子方程式 。
(3)2K37ClO3+4H35Cl=2KCl+2ClO2↑ +Cl2↑ +2H2O在该条件下生成的氯气的摩尔质量为 。
【答案】(1)10Cl2+20OH—![]() 10H2O+3ClO3—+ClO—+16Cl—
10H2O+3ClO3—+ClO—+16Cl—
(2)②3Fe2+ +NO3—+4H+ =3 Fe3++ NO↑+2H2O
(3)70g/mol
【解析】
试题分析:(1)氯气与氢氧化钠在70℃时反应,生成物中NaClO3和NaClO的物质的量之比为3︰1,二者均是氧化产物,其还原产物是氯化钠,根据电子得失守恒以及原子守恒可知反应的离子方程式为10Cl2+20OH—![]() 10H2O+3ClO3—+ClO—+16Cl—。
10H2O+3ClO3—+ClO—+16Cl—。
(2)①SO2通入足量Fe(NO3) 3稀溶液中,溶液由棕色变为浅绿色,说明铁离子把二氧化硫氧化为硫酸,铁离子被还原为亚铁离子;②随着反应的进行上述溶液立即又变为棕黄色,液面上有无色气体产生到试管口为红棕色,这说明溶液的硝酸根在酸性溶液中又把亚铁离子氧化为铁离子,而硝酸根被还原为NO,NO在空气中被氧化为NO2,则②的离子方程式为3Fe2+ +NO3—+4H+ =3 Fe3++ NO↑+2H2O。
(3)在2K37ClO3+4H35Cl=2KCl+2ClO2↑ +Cl2↑ +2H2O中氯气是氧化产物,ClO2是还原产物,即氯气中的氯原子全部来自于氯化氢中的氯原子,因此在该条件下生成的氯气的摩尔质量为70g/mol。