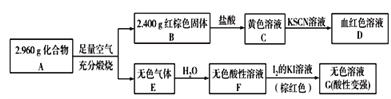
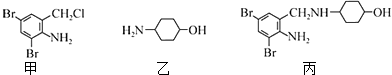
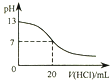
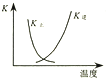
题目内容
【题目】将一定量的铁粉加入100mL稀硫酸中,为中和过量硫酸,且使Fe2+完全转化为Fe(OH)2,共消耗掉2mol·L-1NaOH溶液150mL。原硫酸溶液的浓度是
A. 0.5mol·L-1 B. 1mol·L-1 C. 1.5mol·L-1 D. 2mol·L-1
【答案】C
【解析】将一定量的铁粉加入100mL稀硫酸中,用NaOH溶液中和过量的硫酸并使Fe2+完全转化为Fe(OH)2,反应的化学方程式分别为:Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、H2SO4+2NaOH=Na2SO4+H2O,由反应方程式可知,反应后得到的是Na2SO4溶液,则n(Na2SO4)=![]() n(NaOH)=n(H2SO4)=
n(NaOH)=n(H2SO4)=![]() ×2mol·L-1×0.15L=0.15mol,所以原硫酸溶液的浓度为:c(H2SO4)=0.15mol÷0.1L=1.5 mol·L-1,故答案选C。
×2mol·L-1×0.15L=0.15mol,所以原硫酸溶液的浓度为:c(H2SO4)=0.15mol÷0.1L=1.5 mol·L-1,故答案选C。

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
【题目】下列实验现象描述错误的是
编号 | 实验 | 现象 |
A | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
D | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
A. A B. B C. C D. D