题目内容
【题目】复旦大学教授吴宇平研制的水溶液锂电池体系,最终能实现电动汽车充电10秒即可行驶400公里的目标,其结构如图所示,则下列说法不正确的是
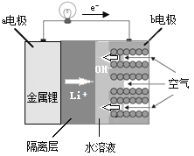
A.b电极采用多孔电极的目的是易于吸附气体
B.a电极为电池的正极,金属锂发生氧化反应
C.b电极的电极反应为O2+2H2O+4e-=4OH-
D.装置中用导电隔离层将电极锂与水溶液隔开的目的是防止金属锂与水发生反应
【答案】B
【解析】
A. b电极通入空气,采用多孔电极的目的是易于吸附气体,A正确;
B.根据电子的流向, a电极为电池的负极,金属锂发生氧化反应,B错误;
C. b电极为电池的正极,氧气放电产生OH-,电极反应为O2+2H2O+4e-=4OH-,C正确;
D. 金属锂不能和水溶液直接接触,否则金属锂易与水发生反应而溶解,D正确;
答案选B。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目