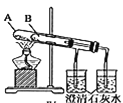
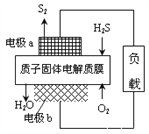
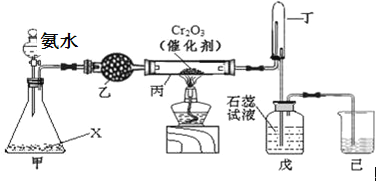
题目内容
【题目】近几年具有超常性能的铝离子电池成为研究热点,某化学研究所研发出了以新型石墨烯(Cn) 作正极材料的铝离子电池,可在一分钟内完成充电,其放电时的工作原理如图所示。下列说法不正确的是
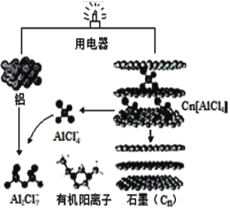
A.充电时,铝电极连接电源负极,该电极有Cn[AlCl4]生成
B.放电时,每生成 1molAl2Cl7-转移电子数目为0.75NA
C.充电时,阴极的电极反应式为4Al2Cl7–+3e–=Al+7AlCl4 –
D.放电时,正极的电极反应式为 Cn[AlCl4]+e–═Cn+AlCl4–
【答案】A
【解析】
由示意图可知放电时铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,正极反应为3Cn[AlCl4]+3e-=3Cn+3AlCl4-,电解时阳极发生氧化反应,电解方程式为Cn+AlCl4--e-═Cn[AlCl4],阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-
A.充电时,负极铝电极连接电源负极,作阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,该电极无Cn[AlCl4]生成,故A错误;
B.放电时,铝为负极,被氧化生成Al2Cl7-,电极方程式为Al+7AlCl4--3e-═4Al2Cl7-,所以每生成1molAl2Cl7-转移电子数目为![]() NA=0.75NA,故B正确;
NA=0.75NA,故B正确;
C.充电时,阴极发生还原反应,电极方程式为4Al2Cl7-+3e-=Al+7AlCl4-,故C正确;
D.放电时,新型石墨烯(Cn)作正极材料,反应为Cn[AlCl4]+e-=Cn+AlCl4-,故D正确;
故选A。

练习册系列答案
相关题目