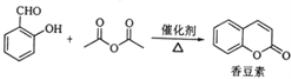
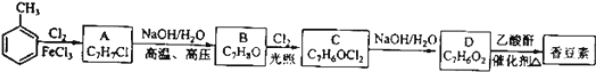
题目内容
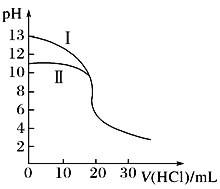
【题目】25℃时,在20ml 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1醋酸溶液,滴定曲线如图所 示,有关粒子浓度的关系中,不正确的是( )

A. 在A点:c(Na+)﹥c(OH-)﹥c(CH3COO-)﹥c(H+)
B. 在B点:c(Na+) ﹦c(CH3COO-) ﹥c(OH-)﹦c(H+)
C. 在C点:c(CH3COO-)﹥c(Na+)﹥c(H+) ﹥c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)﹦2 c(Na+)
【答案】A
【解析】试题分析:A.在A点醋酸和NaOH恰好中和生成CH3COONa,为强碱弱酸盐,水解呈碱性,但CH3COO-水解程度较小,应为c(CH3COO-)>c(OH-),故A错误;B.B点呈中性,则离子浓度大小为:c(Na+)=c(Ac-)>c(OH-)=c(H+),故B正确;C.C点时,n(NaOH)=0.02L×0.1mol/L=0.002mol,n(HAc)=0.02mol/L×0.02L=0.004mol,反应后溶质为等浓度的醋酸和醋酸钠,溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒可知c(CH3COO-)>c(Na+),溶液中离子浓度大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;D.C点溶质为等浓度的醋酸和醋酸钠,根据物料守恒可知:c(CH3COO-)+c(CH3COOH)﹦2c(Na+),故D正确;故选A。

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案【题目】X、Y、Z、W是元素周期表中前36号元素,且原子序数依次增大。其相关信息如下表:
元素编号 | 元素性质或原子结构 |
X | X原子的最外层电子数是其内层电子总数的2倍 |
Y | Y的基态原子价电子排布式为nsnnpn+2 |
Z | 最外层中只有两对成对电子 |
W | 前四周期基态原子中,W元素的未成对电子数最多 |
(1)元素X最高价氧化物分子的空间构型是__________________,是_________(填“极性”或“非极性”)分子。
(2)Y的最简单氢化物的沸点比Z的最简单氢化物的沸点高,原因是____________________________________
(3)基态Z原子中,电子占据的最高电子层符号为_________,该电子层具有的原子轨道数为________________
(4)元素W位于元素周期表的第________族。
【题目】某含铬污泥主要含Cr2O3、Al2O3、Fe2O3等物质,该污泥可以用湿法回收利用,流程如下图所示:
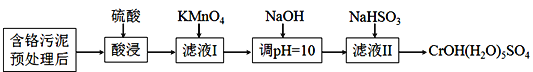
已知:室温下部分氢氧化物的Ksp见下表
Al(OH)3 | Fe(OH)3 | Cr(OH)3 | Mn(OH)2 | |
Ksp | 3×10-34 | 4×10-38 | 6×10-31 | 4×10-14 |
(1)酸浸前,对含铬污泥进行预处理即加水湿磨成浆体,湿磨的作用是_____________。
(2)向滤液I加KMnO4氧化Cr3+的离子方程式是________________________________;将Cr3+氧化的目的是____________________________________________________。
(3)室温下,调pH=10时, ![]() =_____;调溶液pH不能大于10,理由是_________。
=_____;调溶液pH不能大于10,理由是_________。
(4)NaHSO3在反应中的作用是___________;理论上n(NaHSO3):n[CrOH(H2O)5SO4]之比是_______________。
(5)NaHSO3固体在空气中易变质,写出检验NaHSO3是否变质的方法______________。