题目内容
【题目】硫酸铵是一种常见的化肥,某工厂用石膏、NH3、H2O、CO2制备硫酸铵的工艺流程如下:
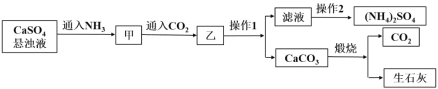
下列说法不正确的是
A. 操作1为过滤,操作2为蒸馏
B. 滤液中的主要阳离子可通过向少量滤液中加NaOH溶液,加热,并用湿润的红色石蕊试纸来检验
C. 甲到乙反应的离子方程式为CaSO4+2NH3+CO2+H2O==CaCO3↓+2NH4++ SO42-
D. 工艺流程中产生的CO2可循环利用
【答案】A
【解析】
流程中,向硫酸钙浊液中通入足量的氨气,使溶液呈碱性,再通入适量的二氧化碳,硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀,加热硫酸铵溶液制成饱和溶液,再降温冷却结晶,过滤,得到硫酸铵晶体;碳酸钙煅烧生成氧化钙和二氧化碳,据此分析解答。
A.操作1为过滤,操作2是溶液中得到溶质固体的过程,需要蒸发浓缩、冷却结晶、过滤洗涤干燥等,故A错误;B.滤液中阳离子为铵根离子,向少量滤液中加NaOH溶液,加热,生成能使湿润的红色石蕊试纸变蓝的气体氨气来检验铵根离子,故B正确;C.硫酸钙与氨气、水和二氧化碳反应生成了硫酸铵和碳酸钙沉淀物质发生的主要化学反应为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4,反应的离子方程式为:CaSO4+2NH3+CO2+H2O═CaCO3↓+2NH4++SO42-,故C正确;D.反应过程中二氧化碳参与反应生成硫酸铵和碳酸钙,碳酸钙分解生成二氧化碳,工艺流程中产生的CO2可循环利用,故D正确;故选A。

【题目】有X、Y、Z、W四种短周期主族元素,原子序数依次增大,元素性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
X | 原子核内没有中子 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 最内层电子数是最外层的2倍 |
W | 本周期元素中原子半径最小 |
请回答:
(1)写出元素Z在周期表中的位置______,画出元素W的原子结构示意图______。
(2)Y与W相比,气态氢化物稳定性较弱的是________(填化学式,下同),两元素最高价氧化物对应水化物酸性更强的是__________。
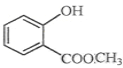
(3)X、Y、Z三种元素可以形成化合物ZYX2,可与化合物XW发生反应,生成两种盐,写出该反应的化学方程式________________。