题目内容
【题目】X、Y、Z、W是元素周期表中前36号元素,且原子序数依次增大。其相关信息如下表:
元素编号 | 元素性质或原子结构 |
X | X原子的最外层电子数是其内层电子总数的2倍 |
Y | Y的基态原子价电子排布式为nsnnpn+2 |
Z | 最外层中只有两对成对电子 |
W | 前四周期基态原子中,W元素的未成对电子数最多 |
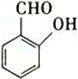
(1)元素X最高价氧化物分子的空间构型是__________________,是_________(填“极性”或“非极性”)分子。
(2)Y的最简单氢化物的沸点比Z的最简单氢化物的沸点高,原因是____________________________________
(3)基态Z原子中,电子占据的最高电子层符号为_________,该电子层具有的原子轨道数为________________
(4)元素W位于元素周期表的第________族。
【答案】 直线型 非极性 H2O分子间能形成氢键 M 9 ⅥB
【解析】试题分析:本题考查元素的推断,分子空间构型和分子极性的判断,物质沸点高低的比较,元素在周期表中的位置。X原子的最外层电子数是其内层电子总数的2倍,X为C元素;Y的基态原子价电子排布式为nsnnpn+2,由于np能级排有电子,则ns上排有2个电子即n=2,Y的基态原子价电子排布式为2s22p4,Y为O元素;X、Y、Z的原子序数依次增大,Z的最外层中只有两对成对电子,Z为S元素;W为前四周期基态原子中未成对电子数最多的元素,W为Cr元素。
(1)元素X的最高价氧化物为CO2,CO2中中心原子C上的孤电子对数=![]() (4-2
(4-2![]() 2)=0,成键电子对数为2,价层电子对数为0+2=2,VSEPR模型为直线型,由于C上没有孤电子对,CO2分子的空间构型为直线型。CO2分子为直线型,键角为180,正电中心和负电中心重合,CO2为非极性分子。
2)=0,成键电子对数为2,价层电子对数为0+2=2,VSEPR模型为直线型,由于C上没有孤电子对,CO2分子的空间构型为直线型。CO2分子为直线型,键角为180,正电中心和负电中心重合,CO2为非极性分子。
(2)Y的最简单氢化物为H2O,Z的最简单氢化物为H2S,H2O的沸点比H2S高的原因是:H2O分子间能形成氢键,H2S分子间不能形成氢键。
(3)基态Z原子的核外电子排布式为1s22s22p63s23p4,电子占据的最高电子层为第三电子层,第三电子层的符号为M。第三电子层具有的原子轨道数为32=9。
(4)W为Cr元素,基态Cr原子核外电子排布式为1s22s22p63s23p63d54s1,Cr位于元素周期表中第四周期第VIB族。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG) 相似,被誉为“21世纪的清洁燃料”。制备原理如下:
I.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
CH3OCH3(g) +H2O(g) △H1=- 283.6 kJ/mol
II.由合成气制备二甲醚:
②CO(g) +2H2(g)![]() CH3OH(g) △H2=- 90.7 kJ/mol
CH3OH(g) △H2=- 90.7 kJ/mol
③2CH3OH (g)![]() CH3OCH3(g) +H2O(g) △H3
CH3OCH3(g) +H2O(g) △H3
回答下列问题:
(1) 反应③中的相关的化学键键能数据如表:
化学键 | H—H | C—O | H—O(水) | H—O(醇) | C—H |
E/(kJ/mol ) | 436 | 343 | 465 | 453 | 413 |
△H3=_______kJ/mol。
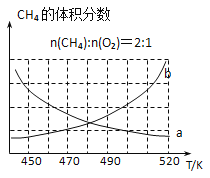
(2) 制备原理I中,在恒温、恒容的密闭容器中合成,将气体按n(CH4): n(O2) =2: 1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_______。下列能表明反应①达到化学平衡状态的是________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变
(3) 有人模拟制备原理II,在500K时的2L 的密闭容器中充入2mol CO和6mol H2,8min达到平衡,平衡时CO 的转化率为80%,c(CH3OCH3)=0.3mol/L,用H2表示反应②的速率是______;可逆反应③的平衡常数K=_______。若在500K 时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v ( 正)______v (逆),说明原因________________。