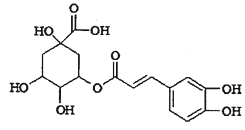
题目内容
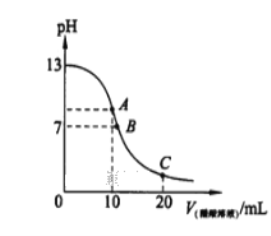
【题目】室温下,用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1氢氧化钾溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示。下列说法正确的是( )

A. Ⅰ表示的是滴定氨水的曲线
B. 当pH=7时,滴定氨水消耗的V(HCl)<20 mL,且此时溶液中c(NH4+)=c(Cl-)
C. 滴定氢氧化钾溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(H+)>c(K+)>c(OH-)
D. 当滴定氨水消耗V(HCl)=10 mL时,c(NH3·H2O)>c(NH4+)>c(Cl-)>c(OH-)>c(H+)
【答案】B
【解析】A、KOH为强碱,NH3·H2O是弱碱,相同浓度时,NH3·H2O的pH小于KOH,因此II表示的是滴定氨水的曲线,故A错误;B、恰好完全反应时,溶质为NH4Cl,溶液显酸性,因此pH=7时,溶质为NH4Cl和NH3·H2O,消耗的V(HCl)<20mL,根据电荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),pH=7时,c(H+)=c(OH-),即c(NH4+)=c(Cl-),故B正确;C、当V(HCl)>20mL,溶质为KCl和HCl,离子浓度大小顺序可能是c(Cl-)>c(K+)>c(H+)>c(OH-),也可能是c(Cl-)>c(H+)>c(K+)>c(OH-),故C错误;D、当V(HCl)=10mL时,溶质为NH3·H2O和NH4Cl,且两者物质的量相等,根据图像,V(HCl)=10mL时,溶液显碱性,即NH3·H2O的电离程度大于NH4+水解程度,因此离子浓度大小顺序是c(NH4+)>c(Cl-)>c(NH3·H2O)>c(OH-)>c(H+),故D错误。

【题目】下表列出了某短周期元素R的各级电离能数据(单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )
I1 | I2 | I3 | I4 | …… | |
R | 577.5 | 1816.7 | 2744.8 | 11577 |
①R的主要化合价中最高正价为+3价 ②R元素位于元素周期表中第ⅡA族
③R元素第一电离能小于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s22p1
A. ①② B. ②③ C. ③④ D. ①③