��Ŀ����
����Ŀ���мס�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾�ʹ��þƬ����Ƭ���缫������ͬѧ���缫����6mol L-1��H2SO4��Һ�У���ͬѧ���缫����6mol L-1NaOH����Һ�У���ͼ��ʾ��
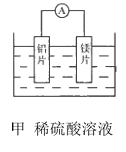
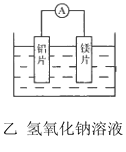
��1��д������������ĵ缫��Ӧʽ��________.
��2��д���ҵ�����ܷ�Ӧ�����ӷ���ʽ��_________.
��3�����������ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ������ɸ������ϵĽ���Ӧ�ȹ����������ϵĽ������á�������жϳ�______(��дԪ�ط���,��ͬ)�Ľ�����Ը�ǿ,���һ��жϳ�___�Ľ�����Ը�ǿ��
��4���ɴ�ʵ�飬�ɵõ�������Щ��ȷ������______��
A������ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
B��þ�Ľ�����Բ�һ�������Ľ������ǿ
C����ʵ��˵���������˳���ѹ�ʱ����û��ʹ�ü�ֵ
D����ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ��������������
��5����5.1gþ���Ͻ�����60 mL5.0 mol L-1H2SO4��Һ��,��ȫ�ܽ���ټ���65mL10.0mol L-1��NaOH��Һ���õ���������Ϊ9.7g�������μ�NaOH��Һʱ��������١�
�ٵ�����____mLNaOH��Һʱ����ʹ�ܽ��������е�Mg2+��Al3+ǡ����ȫ������
�ڼ���Ͻ���������ʱ�������������ڱ�״����Ϊ_____L
���𰸡�2H+ + 2e- = H2�� 2Al + 2OH- + 2H2O = 2AlO2- + 3H2�� Mg Al AD 60 5.6
��������
��1������ܷ�ӦΪMg + 2H+ = Mg2+ + H2�����������ϼ���֪������Al�缫��Al�缫�����H+�õ��ӻ�ԭ��H2���缫��ӦʽΪ2H+ + 2e- = H2����
��2��Mg��Ȼ��Al���ã���Mg����NaOH��Һ��Ӧ����Al���Ժ�NaOH��Ӧ����H2������ҵ���ܷ�Ӧ�����ӷ���ʽΪ2Al + 2OH- + 2H2O = 2AlO2- + 3H2����
��3������������ط�Ӧ��֪���ж�Mg���������������ΪMg�Ƚϻ��ã����һ�۲쵽Al�缫�ܽ⣬��Alʧ���ӣ�Al������������һ���ΪAl�Ƚϻ��á�
��4��A.��Ȼ���ҵ�صĵ缫������ȫ��ͬ�������Һ��ͬ����������������ת���������ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ��ʣ���ȷ��
B.������������ָ�����Խ�ǿ�Ľ��������ܴӽ�����������Һ���û��������Խϲ�Ľ������ʣ�������ʵ��Mgһ����Al���ã�����
C.�������������жϽ�����ѧ���ʵ���Ի��Ե���Ҫ�ֶΣ�����
D.�����þ���Ļ�ѧ����ʱ����Ӧ�̰���ǿ�н��Ͳ�ͬ�����µ��������⣬Ӧ�����������Դ����Ӷ����ջ�ѧ����ı��ʣ���ȷ��
�ʴ�ѡAD��
��5����n(H2SO4)=0.06L��5mol/L=0.3mol���������е�Mg��Alǡ����ȫ����ʱ����Һ�ɷ�ΪNa2SO4����ʱn(NaOH)=2n(H2SO4)=2��0.3mol=0.6mol������V(NaOH)=0.6mol/10mol/L=0.06L=60mL��
�ڵ�����60mL NaOH��Һʱ��þ��ǡ�ó�����������n(NaOH)=0.065L��10mol/L=0.65molʱ��NaOH���������ʵ���Ϊ��0.65mol-0.6mol=0.05mol��������ӦΪ��Al(OH)3+NaOH=NaAlO2+2H2O�����ܽ��n[Al(OH)3]=0.05mol��m[Al(OH)3]=0.05mol��78g/mol=3.9g�����������е�Mg��Alǡ����ȫ����������ӦΪ��3.9g+9.7g=13.6g���������к���xmolMg��ymolAl����24x+27y=5.1��58x+78y=13.6����ã�x=0.1��y=0.1��
Mg + H2SO4 = MgSO4 + H2��
0.1mol 0.1mol
2Al + 3H2SO4 = Al2(SO4)3 + 3H2��
0.1mol 0.15mol
n(H2)=0.1mol+0.15mol=0.25mol�������������ڱ�״���µ����Ϊ��V(H2)=0.25mol��22.4L/mol=5.6L��

����Ŀ�������ӻ�������ۺͼ۵��ӶԻ���ģ���жϣ����з��ӻ������ӵ�����ԭ���ӻ���ʽ���ռ乹����ȷ���ǣ� ��
ѡ�� | ���ӻ����� | ����ԭ���ӻ���ʽ | �۵��ӶԻ���ģ�� | ���ӻ����ӵ����幹�� |
A�� | SO2 | sp | ֱ���� | ֱ���� |
B�� | HCHO | sp2 | ƽ�������� | ������ |
C�� | NF3 | sp2 | �������� | ƽ�������� |
D�� |
| sp3 | ���������� | ���������� |
A. AB. BC. CD. D