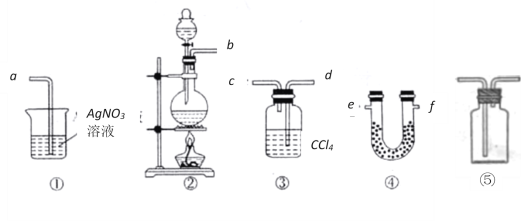
题目内容
【题目】实验室常用乙醇与浓硫酸的混合液加热的方法制取乙烯。反应中常因温度而发生副反应。请选用下列装置(装置可以使用多次)完成相关实验并回答有关问题:
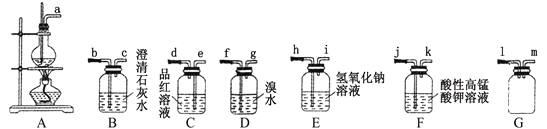
(1)制备乙烯时,常在A装置的烧瓶中加入碎瓷片,其目的是______________________;加热时要使溶液的温度迅速上升到140℃以上,因为在140℃左右易生成乙醚,该有机物的结构简式为_____________;生成乙烯的化学方程式为_____________________。
(2)乙醇与浓硫酸加热制取乙烯时,乙烯气体中常混有SO2和 CO2,为验证有副产物SO2和 CO2气体存在,上述仪器的连接顺序为a→_________________________________。
(3)某同学设计制备1,2-二溴乙烷的装置连接顺序为A→E→C→D。已知1,2-二溴乙烷的主要物理性质有:难溶于水、熔点9℃、沸点132℃、密度2.2 g·cm-3。
①E装置的作用_________________________;
②分离D装置中1,2-二溴乙烷的操作方法是加入试剂_______________ ,充分反应后进行______________操作。
③反应过程中,应将D装置放在10℃的水浴中,温度不宜过低、过高的原因是__________________________________________________。
(4)请设计验证酸性高锰酸钾溶液能将乙烯氧化为CO2的实验方案。装置连接顺序为A→_________________________________________________。
【答案】 防止暴沸 C2H5-O-C2H5 C2H5OH ![]() CH2=CH2+H2O e,d→f,g→e,d→b,c 除去CO2和SO2 NaHSO3 分液 温度过低,1,2-二溴乙烷凝结堵塞导管;温度过高,溴挥发,降低溴 元素利用率 E→B→F→B
CH2=CH2+H2O e,d→f,g→e,d→b,c 除去CO2和SO2 NaHSO3 分液 温度过低,1,2-二溴乙烷凝结堵塞导管;温度过高,溴挥发,降低溴 元素利用率 E→B→F→B
【解析】(1)制备乙烯时,发生装置的烧瓶中加入碎瓷片,可以防止暴沸;加热时要使溶液的温度迅速上升到140℃以上,因为在140℃左右易生成乙醚,乙醚的结构简式为C2H5-O-C2H5;在170℃时生成乙烯的化学方程式为C2H5OH ![]() CH2=CH2+H2O,故答案为:防止暴沸;C2H5-O-C2H5;C2H5OH
CH2=CH2+H2O,故答案为:防止暴沸;C2H5-O-C2H5;C2H5OH ![]() CH2=CH2+H2O;
CH2=CH2+H2O;
(2)乙醇与浓硫酸加热制取乙烯时,浓硫酸具有脱水性和强氧化性,制得的乙烯气体中常混有SO2和 CO2,为验证有副产物SO2和 CO2气体存在,需要首先选用品红溶液具有二氧化硫,然后将二氧化硫用溴水除去,不能选用酸性高锰酸钾溶液,因为高锰酸钾能够将乙烯氧化生成二氧化碳,再用品红溶液检验二氧化硫是否除干净,最后用澄清石灰水具有二氧化碳,上述仪器的连接顺序为a→e,d→ f,g→ e,d → b,c,故答案为:e,d→ f,g→ e,d → b,c;
(3)①E装置中的氢氧化钠可以除去乙烯气体中二氧化硫和二氧化碳,故答案为:除去CO2和SO2;
②1,2-二溴乙烷难溶于水,分离D装置中1,2-二溴乙烷,需要先加入NaHSO3,除去溴,充分反应后分液即可,故答案为:NaHSO3;分液;
③反应过程中,应将D装置放在10℃的水浴中,温度不宜过低、过高,因为温度过低,1,2-二溴乙烷凝结堵塞导管;温度过高,溴挥发,降低溴 元素利用率,故答案为:温度过低,1,2-二溴乙烷凝结堵塞导管;温度过高,溴挥发,降低溴 元素利用率;
(4)验证酸性高锰酸钾溶液能将乙烯氧化为CO2,需要首先将反应生成物中的二氧化硫和二氧化碳除去,再将乙烯用高锰酸钾氧化,用澄清的石灰水具有,装置连接顺序为A→E→B→F→B,故答案为:E→B→F→B。

 阅读快车系列答案
阅读快车系列答案