题目内容
9.Ⅰ、高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:(1)制备MnSO4溶液:在烧瓶中(装置见图甲)加入一定量MnO2和水,搅拌,通入 SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O).
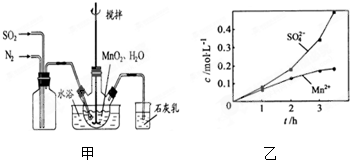
①石灰乳作用:吸收多余的二氧化硫.
②若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图乙.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是氧气和亚硫酸反应生成硫酸.
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿 时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7,请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤:
[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH].
①边搅拌边加入碳酸钠或碳酸氢钠并控制溶液pH<7.7;
②过滤,并用水洗涤2-3次;
③检验SO42-是否被洗涤除去;
④用少量乙醇洗涤;
⑤低于100℃干燥.
Ⅱ、锌铝合金的主要成分有Zn、Al、Cu、Si等元素.实验室测定其中Cu含量的步骤如下:①称取该合金样品1.1g,用HCl和H2O2溶解后,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中.
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,用0.01100mol?L-1Na2S2O3溶液滴定生成的I2至终点(反应:I2+2S2O32-=2I-+S4O62-),消耗Na2S2O3溶液6.45mL.
(1)判断步骤②滴定终点的方法是当滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色突变为无色且半分钟不变色.
(2)计算合金中Cu的质量分数2.064%.
分析 I.(1)二氧化硫和水反应生成亚硫酸,亚硫酸和MnO2发生反应MnO2+H2SO3=MnSO4+H2O,二氧化硫有毒,不能直接排空,且二氧化硫是酸性氧化物,可以用碱液吸收;如果将氮气换为空气,亚硫酸被氧气氧化生成硫酸;
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7,由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤:
①将硫酸锰和碳酸钠或碳酸氢钠溶液混合,并保证溶液的pH<7.7,防止生成Mn(OH)2沉淀;
②过滤、洗涤沉淀;
③检验SO42-是否被洗涤除去;
④用少量乙醇洗涤,减少碳酸锰的溶解,从而减少碳酸锰的损失;
⑤碳酸锰100℃开始分解,所以要低于100℃干燥,从而得到较干燥、纯净的碳酸锰;
Ⅱ、锌铝合金的主要成分有Zn、Al、Cu、Si等元素.
实验室测定其中Cu含量的步骤如下:
①称取该合金样品1.1g,稀盐酸能溶解Al、Zn,铜、双氧水和稀盐酸发生氧化还原反应生成氯化铜和水,所以用HCl和H2O2溶解后,剩余的固体是Si,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中;
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,铝离子和锌离子不反应,再用硫代硫酸钠滴定碘,根据铜离子、碘、硫代硫酸根离子之间关系式计算铜含量.
(1)碘遇淀粉试液变蓝色,根据溶液颜色确定滴定终点,溶液由蓝色突变为无色,且半分钟内不变色;
(2)发生反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,根据关系式2Cu~2Cu2+~I2~2S2O32-计算n(Cu),再计算m(Cu),据此计算合金中Cu的质量分数.
解答 解:I.(1)二氧化硫和水反应生成亚硫酸,亚硫酸和MnO2发生反应MnO2+H2SO3=MnSO4+H2O,二氧化硫有毒,不能直接排空,且二氧化硫是酸性氧化物,可以用碱液吸收;如果将氮气换为空气,亚硫酸被氧气氧化生成硫酸,
①二氧化硫有毒不能直接排空,且二氧化硫是酸性氧化物,能与碱反应,所以用氢氧化钙溶液吸收未反应的二氧化硫,
故答案为:吸收多余的二氧化硫;
②二氧化硫和水反应生成亚硫酸,亚硫酸不稳定易被氧气氧化,空气中含有氧气,所以将亚硫酸氧化硫酸,导致溶液中硫酸根离子浓度增大,
故答案为:氧气和亚硫酸反应生成硫酸;
(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7,由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤:
①将硫酸锰和碳酸钠或碳酸氢钠溶液混合,并保证溶液的pH<7.7,防止生成Mn(OH)2沉淀;
②过滤、洗涤沉淀;
③检验SO42-是否被洗涤除去;
④用少量乙醇洗涤,减少碳酸锰的溶解,从而减少碳酸锰的损失;
⑤碳酸锰100℃开始分解,所以要低于100℃干燥,从而得到较干燥、纯净的碳酸锰;
①将硫酸锰和碳酸钠或碳酸氢钠溶液混合,并保证溶液的pH<7.7,防止生成Mn(OH)2沉淀,所以该操作方法是:边搅拌边加入碳酸钠或碳酸氢钠并控制溶液pH<7.7,故答案为:边搅拌边加入碳酸钠或碳酸氢钠并控制溶液pH<7.7;
②然后的操作是过滤、洗涤沉淀2-3次,达到分离、除杂目的,故答案为:过滤,并用水洗涤2-3次;
Ⅱ.锌铝合金的主要成分有Zn、Al、Cu、Si等元素.
实验室测定其中Cu含量的步骤如下:
①称取该合金样品1.1g,稀盐酸能溶解Al、Zn,铜、双氧水和稀盐酸发生氧化还原反应生成氯化铜和水,所以用HCl和H2O2溶解后,剩余的固体是Si,煮沸除去过量H2O2,过滤,滤液定容于250mL容量瓶中;
②用移液管移取50.00mL滤液于250mL碘量瓶中,控制溶液的pH=3~4,加入过量KI溶液(生成CuI和I2)和指示剂,铝离子和锌离子不反应,再用硫代硫酸钠滴定碘,根据铜离子、碘、硫代硫酸根离子之间关系式计算铜含量.
(1)碘遇淀粉试液变蓝色,根据溶液颜色确定滴定终点,溶液由蓝色突变为无色,且半分钟内不变色,所以滴定终点判断方法是:当滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色突变为无色且半分钟不变色,
故答案为:当滴入最后一滴硫代硫酸钠溶液时,溶液由蓝色突变为无色且半分钟不变色;
(2)可知发生反应2Cu2++4I-=2CuI↓+I2,I2+2S2O32-=2I-+S4O62-,
根据关系式:2Cu~~~~~~2Cu2+~~~~~I2~~~~2S2O32-,
2 2
n(Cu) 0.01100mol/L×6.45×10-3L×5
所以 n(Cu)=0.01100mol/L×6.45×10-3L×5=5.5×6.45×10-5mol,
合金中Cu的质量分数为$\frac{5.5×6.45×1{0}^{-5}mol×64g/mol}{1.1g}$×100%=2.064%,
故答案为:2.064%.
点评 本题考查物质制备、物质的分离和提纯,为高频考点,明确实验原理及物质性质是解本题关键,侧重考查学生获取信息、自学能力及分析解答问题能力,熟悉操作过程中发生的反应及基本操作方法,注意II(2)中铜离子和碘离子反应时只有一半碘离子作还原剂,为易错点.

| A. | 57g | B. | 57g/mol | C. | 74g | D. | 74g/mol |
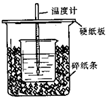 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.(1)从实验装置上看,图中尚缺少的一种玻璃用品是环形玻璃搅拌棒.
(2)烧杯间填满碎纸条的作用是减少实验过程中的热量损失.
(3)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | 4.0 |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括: