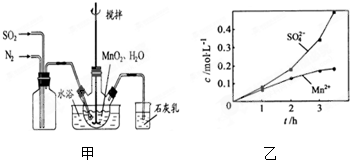
题目内容
4.实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如图1: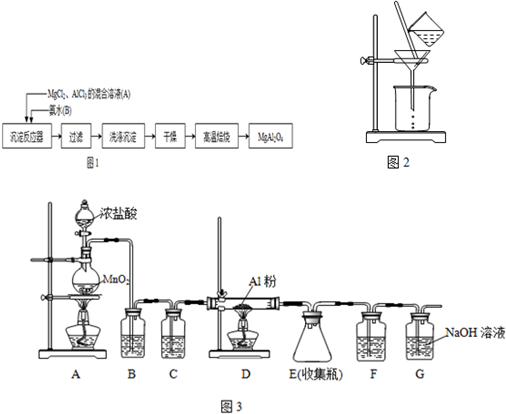
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入B(填“A”或“B”),再滴加另一反应物.
(2)如图2所示,过滤操作中的一处错误是漏斗下端尖嘴未紧贴烧杯内壁.
(3)判断流程中沉淀是否洗净所用的试剂是AgNO3溶液(或硝酸酸化的AgNO3溶液).高温焙烧时,用于盛放固体的仪器名称是坩埚.
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用图3装置制备.
①装置A中反应的化学方程式是MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O.
②装置B中盛放饱和NaCl溶液,该装置的主要作用是除去HCl.
③F中试剂的作用是吸收水蒸气.用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为碱石灰.
分析 本题是实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程,涉及操作过程中为了同时得到氢氧化镁和氢氧化铝,需要向氨水中滴加盐溶液,过滤时需要将漏斗的下端尖嘴紧靠烧杯的内壁,使滤液沿器壁流下,还探究了氯化铝遇水强水解的反应原理,据此可答;
(1)先加入氨水,再加入盐的混合溶液,会使两种沉淀同时生成;
(2)为了防止液体溅出,在过滤时应该将漏斗的尖嘴部分紧贴烧杯的内壁;
(3)根据题意可知,沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入硝酸酸化的硝酸银溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净;
(4)根据所给的装置图可知,①装置A是实验室制氯气,二氧化锰和浓盐酸反应生成氯化锰和氯气以及水,据此书写化学方程式;
②B中的饱和食盐水是为了除去混有的HCl气体;
③因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是吸收空气中的CO2,所以可以加入碱石灰来代替F和G的作用.
解答 解:MgCl2、AlCl3的混合溶液与过量氨水反应会得到氢氧化镁以及氢氧化铝的混合物沉淀,将沉淀洗涤干燥进行焙烧可以得到MgAl2O4;
(1)如先加入MgCl2、AlCl3的混合溶液,再加氨水,氨水少量,应先生成氢氧化镁沉淀,反之,先加氨水,因氨水足量,则同时生成沉淀,故答案为:B;
(2)过滤时应该将漏斗的尖嘴部分紧贴烧杯的内壁,防止液体溅出,故答案为:漏斗下端尖嘴未紧贴烧杯内壁;
(3)沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸性的AgNO3溶液)溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净,高温焙烧固体应在坩埚中进行,
故答案为:AgNO3溶液(或硝酸酸性的AgNO3溶液);坩埚;
(4)①实验室制氯气的化学反应方程式为MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl$\frac{\underline{\;加热\;}}{\;}$MnCl2+Cl2↑+2H2O;
②金属铝可以的氯气之间发生反应生成氯化铝,因为氯化铝遇潮湿空气即产生大量白雾,并且能和HCl反应,制得的氯气中含有氯化氢和水,应该除去,并且要防止空气中水的干扰,F可以吸收水分,防止生成的氯化铝变质,
B中的饱和食盐水是为了除去混有的HCl气体,故答案为:除去HCl;
③因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,G是吸收反应剩余的氯气,因碱石灰既能吸收水气,也能吸收氯气可代替装置F和G,故答案为:吸收水蒸气;碱石灰.
点评 本题考查物质的制备实验设计,题目难度不大,注意把握实验设计的仪器连接顺序,清楚实验原理.

| A. | 二氧化碳塑料是通过加聚反应制得的 | |
| B. | 用上业废弃物二氧化碳生产塑料,有助于缓解温室效应 | |
| C. | 二氧化碳塑料不能在空气中燃烧 | |
| D. | 聚二氧化碳塑料的使用会产生白色污染 |
| A. | Na | B. | Na2O2 | C. | Na2O | D. | Na2CO3 |
| A. | 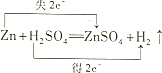 | B. |  | ||
| C. | 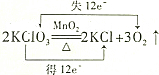 | D. |  |
| 族 周期 | IA | 0 | ||||||
| 1 | a | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | |
| 2 | b | c | d | |||||
| 3 | e | f | ||||||
(2)e的元素符号是Na;
(3)b、c、d、三种元素的非金属性逐渐增强(填减弱或增强);
(4)a元素和f元素形成化合物的电子式为
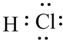 .
.  和
和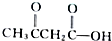 ,试写出A、B的结构简式.
,试写出A、B的结构简式.