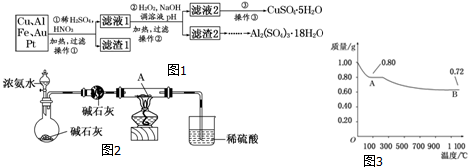
题目内容
19.已知反应:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,下列说法正确的是( )| A. | H2的燃烧热(△H)是285.8kJ•mol-1 | |
| B. | 反应2H2O(g)=2H2(g)+O2(g)H2的焓变(△H)是571.6kJ•mol-1 | |
| C. | 反应2H2O(l)=2H2(g)+O2(g)只能在电解条件下进行 | |
| D. | 反应2H2O(l)=2H2(g)+O2(g)在一定条件下可以自发进行 |
分析 A、燃烧热(△H)是-285.8kJ•mol-1;
B、液态水变化为气体吸热;
C、反应不一定在电解条件下才能进行,也可在高温下进行;
D、根据△G=△H-T•△S<0自发判断.
解答 解:A、燃烧热(△H)是-285.8kJ•mol-1,故A错误;
B、2mol氢气与1mol氧气反应生成2mol液态水放出热量571.6kJ,液态水变化为气体吸热,2mol氢气与1mol氧气反应生成2mol气态水放出热量小于571.6kJ,所以反应2H2O(g)=2H2(g)+O2(g)H2的焓变(△H)大于571.6kJ•mol-1,故B错误;
C、反应不一定在电解条件下才能进行,也可在高温下进行,故C错误;
D、△H>0,△S>0,则在一定温度下当△H<T•△S时,反应可自发进行,故D正确.
故选D.
点评 本题考查了热化学方程式的分析判断,化学反应能量变化和热化学方程式的表达意义是解题关键,题目较简单.

练习册系列答案
相关题目
9.下列实验叙述有错误的是( )
| A. | 实验室制取乙烯气体时,将温度计的水银球放入液面以下 | |
| B. | 向淀粉水解后的溶液中加入碘水,溶液变蓝,证明淀粉尚未水解 | |
| C. | 证明分子CH2=CH-CHO既含有醛基又含有C=C,可先向溶液中先加入足量的银氨溶液加热,充分反应后,再加入足量的溴水 | |
| D. | 在蔗糖与稀硫酸共热后的溶液中,滴加银氨溶液,验证产物中的葡萄糖 | |
| E. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 |
10.下列离子方程式书写正确的是( )
| A. | 铜与浓硫酸反应放出SO2:Cu+4H++SO42-═Cu2++SO2↑+2H2O | |
| B. | 加热NH4Cl和氢氧化钠固体混合物:NH4++OH-═NH3↑+H2O | |
| C. | 稀硝酸与过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2 H2O | |
| D. | 氯气通入FeCl2溶液中:Cl2+2Fe2+═2Fe3++2Cl- |
14.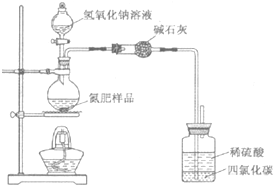 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
氢氧化钠少量时2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如下,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
请计算(计算结果保留两位小数):
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
③若样品质量为31.00g,则生成氨气的质量为1.53 g.
 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:氢氧化钠少量时2NH4HSO4+2NaOH=(NH4)2SO4+Na2SO4+2H2O
氢氧化钠过量时NH4HSO4+2NaOH=Na2SO4+NH3↑+2H2O
(1)同学们设计的实验装置图如下,请回答相关问题.
①装置中碱石灰的作用是吸收氨气中的水蒸气.
②广口瓶内四氯化碳的作用是防止倒吸.
③指导老师指出,用该装置进行实验,即使氢氧化钠足量且实验过程中无氨气外逸,测得的样品含氮量仍将偏低,其原因可能是残留在反应装置中的氨气未被稀硫酸吸收.
(2)同学们改进实验装置后(改进装置图略),进行如下实验.称取不同质量的上述样品分别与40.00mL相同浓度的氢氧化钠溶液混合,完全溶解后,加热充分反应(此温度下铵盐不分解),并使生成的氨气全部被稀硫酸吸收,测得氨气的质量.部分实验数据如下:
| 氢氧化钠溶液/mL | 40.00 | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
①样品中氮元素的质量分数是19.87%.
②所用氢氧化钠溶液的物质的量浓度为3.25 mol/L.
③若样品质量为31.00g,则生成氨气的质量为1.53 g.
4.常温下,将盐酸和一元碱BOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
根据实验结果,回答下列问题:
(1)试写出BOH在溶液中的电离方程式:BOH?B++OH-
(2)甲组混合溶液中离子浓度由大到小的顺序为:c(Cl-)>c(B+)>c(H+)>c(OH-)
(3)乙组混合溶液中B-离子浓度c(B-)=0.05 mol/L
(4)丙组混合溶液中c(BOH)、c(B-)、c(Cl-)浓度大小关系为c(BOH)>c(B+)>c(Cl-)
(5)根据乙组实验,列式并计算BOH在常温下的电离平衡常数Kb=5×10-8.
| 实验序号 | HCl溶液浓度(mol/L) | BOH溶液溶液(mol/L) | 混合后溶液pH |
| 甲 | 0.10 | 0.10 | 4.7 |
| 乙 | 0.10 | 0.30 | 7 |
| 丙 | 0.10 | 0.50 | 8.2 |
(1)试写出BOH在溶液中的电离方程式:BOH?B++OH-
(2)甲组混合溶液中离子浓度由大到小的顺序为:c(Cl-)>c(B+)>c(H+)>c(OH-)
(3)乙组混合溶液中B-离子浓度c(B-)=0.05 mol/L
(4)丙组混合溶液中c(BOH)、c(B-)、c(Cl-)浓度大小关系为c(BOH)>c(B+)>c(Cl-)
(5)根据乙组实验,列式并计算BOH在常温下的电离平衡常数Kb=5×10-8.
 .若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是3,3-二甲基-1-丁烯,结构简式是(CH3)3C-CH=CH2.比烃A少两个碳原子且能使溴水褪色的A的同系物有3种同分异构体.
.若烃A能使溴水褪色,在催化剂作用下,与H2加成反应后生成2,2-二甲基丁烷,则烃A的名称是3,3-二甲基-1-丁烯,结构简式是(CH3)3C-CH=CH2.比烃A少两个碳原子且能使溴水褪色的A的同系物有3种同分异构体.
 .
. .
. .
.