题目内容
10.下列离子方程式书写正确的是( )| A. | 铜与浓硫酸反应放出SO2:Cu+4H++SO42-═Cu2++SO2↑+2H2O | |
| B. | 加热NH4Cl和氢氧化钠固体混合物:NH4++OH-═NH3↑+H2O | |
| C. | 稀硝酸与过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2 H2O | |
| D. | 氯气通入FeCl2溶液中:Cl2+2Fe2+═2Fe3++2Cl- |
分析 A.浓硫酸在离子反应中保留化学式;
B.加热NH4Cl和氢氧化钠固体混合物,没有离子参加反应;
C.与过量的铁屑反应,生成硝酸亚铁、NO和水;
D.反应生成氯化铁,遵循电子、电荷守恒.
解答 解:A.铜与浓硫酸反应放出SO2的离子反应为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+SO42-+2H2O,故A错误;
B.加热NH4Cl和氢氧化钠固体混合物,没有离子参加反应,不能写离子反应,故B错误;
C.稀硝酸与过量的铁屑反应的离子反应为3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故C错误;
D.氯气通入FeCl2溶液中的离子反应为Cl2+2Fe2+═2Fe3++2Cl-,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
相关题目
20.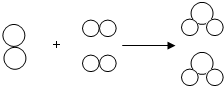 右图是用比例模型来表示某物质发生化学变化的微观示意图.图中
右图是用比例模型来表示某物质发生化学变化的微观示意图.图中 和
和 分别表示两种元素的原子,能用该图表示的化学反应是( )
分别表示两种元素的原子,能用该图表示的化学反应是( )
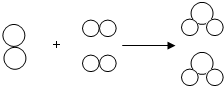 右图是用比例模型来表示某物质发生化学变化的微观示意图.图中
右图是用比例模型来表示某物质发生化学变化的微观示意图.图中 和
和 分别表示两种元素的原子,能用该图表示的化学反应是( )
分别表示两种元素的原子,能用该图表示的化学反应是( )| A. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | B. | 2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO | ||
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | D. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 |
1.下列分子中,所有原子最外层均为8电子结构的是( )
| A. | BeCl2 | B. | H2S | C. | PCl3 | D. | SF6 |
5.一定条件下,向一带活塞的密闭容器中充入1mol N2和3mol H2,发生下列反应:N2(g)+3H2(g)?2NH3(g),反应达到平衡后,改变下述条件,NH3平衡浓度不改变的是( )
| A. | 保持温度和容器压强不变,充入1mol NH3(g) | |
| B. | 保持温度和容器体积不变,充入1mol NH3(g) | |
| C. | 保持温度和容器压强不变,充入1mol N2(g) | |
| D. | 保持温度和容器体积不变,充入1mol H2(g) |
15.香烟烟雾中含有CO、CO2、SO2、H2O等气体,用A.无水硫酸铜、B.澄清石灰水、C.红热氧化铜、D.生石灰、E.酸性品红溶液,F.酸性高锰酸钾溶液等将其一一检出,检出的正确顺序是( )
| A. | 混合气体→A→E→B→A→D→C | B. | 混合气体→C→D→E→E→A | ||
| C. | 混合气体→A→E→F→E→B→D→C | D. | 混合气体→B→E→A→D→C |
2.下列表示对应化学反应的离子方程式.其中正确的是( )
| A. | 向NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | NH4HCO3溶液中加入过量氢氧化钠溶液:NH4++OH-═NH3.H2O | |
| C. | AlCl3溶液中滴加过量氨水:Al3++3NH3.H2O═3NH4++Al(OH)3↓ | |
| D. | 磁性氧化铁(Fe3O4)溶于稀硝酸3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
19.已知反应:2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ•mol-1,下列说法正确的是( )
| A. | H2的燃烧热(△H)是285.8kJ•mol-1 | |
| B. | 反应2H2O(g)=2H2(g)+O2(g)H2的焓变(△H)是571.6kJ•mol-1 | |
| C. | 反应2H2O(l)=2H2(g)+O2(g)只能在电解条件下进行 | |
| D. | 反应2H2O(l)=2H2(g)+O2(g)在一定条件下可以自发进行 |
18.高锰酸钾[KMnO4]是常用的氧化剂.工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体.中间产物为锰酸钾[K2MnO4].如图1是实验室模拟制备的操作流程:

相关资料:
①物质溶解度
②锰酸钾[K2MnO4]
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚,实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,请用离子方程式表示实验中通入适量CO2时导致体系中KMnO4产品纯度降低的原因:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-;
(3)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
外观性状:墨绿色结晶.其水溶液呈深绿色,这是锰酸根(MnO42-)的特征颜色.
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42-会发生歧化反应.
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚,实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为2MnO2+4KOH+O2$\frac{\underline{\;高温\;}}{\;}$2K2MnO4+2H2O.
(2)实验时,若CO2过量会生成KHCO3,请用离子方程式表示实验中通入适量CO2时导致体系中KMnO4产品纯度降低的原因:3MnO42-+2CO2═2MnO4-+MnO2↓+2CO32-;
(3)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式2K2MnO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2KMnO4+H2↑+2KOH;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低.有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图2).图中A口加入的溶液最好为KOH溶液.使用阳离子交换膜可以提高Mn元素利用率的原因为阳离子交换膜防止锰酸根进入阴极区被还原.