题目内容
17.下列判断正确的是( )| A. | T℃时,KW=1.0×10-12.该温度下,PH=3的溶液中,水电离出的c(H+)=1.0×10-11 | |
| B. | 25℃时,PH=a的氨水与PH=b的盐酸等体积混合至溶液呈中性,则a+b=14 | |
| C. | 0.1mol/LNaHCO3溶液中:c(HCO3-)>c(CO32-)>c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.05mol/LNaOH溶液等体积混合,所得溶液中,2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-) |
分析 A.若为盐溶液,促进了水的电离,若为酸溶液,抑制了水的电离,据此进行分析;
B.a=14-b,则室温下pH=a的氨水中氢离子浓度=10-amol/L=10b-14mol/L,氨水中氢氧根离子浓度$\frac{1{0}^{-14}}{1{0}^{b-14}}$mol/L=10-bmol/L,氨水为弱碱,则氨水的物质的量浓度大于10-bmol/L;pH=b的盐酸的浓度为10-bmol/L,等体积混合,氨水的物质的量大于硝酸的物质的量;
C.碳酸氢钠溶液中碳酸氢根离子的水解程度大于其电离程度,则c(H2CO3)>c(CO32-);
D.混合液中溶质为等浓度的醋酸和醋酸钠,根据混合液中的电荷守恒和物料守恒判断.
解答 解:A.T℃时,KW=1.0×10-12,该温度下pH=3的溶液中的氢离子浓度为c(H+)=1.0×10-3mol/L,若为酸溶液,酸电离的氢离子抑制了水的电离,则水电离出的c(H+)=1.0×10-9mol/L,若为强酸弱碱盐溶液,则溶液中的氢离子是水电离电离,水电离出的c(H+)=1.0×10-3mol/L,故A错误;
B.根据a+b=14可知a=14-b,则室温下pH=a的氨水中氢离子浓度=10-amol/L=10b-14mol/L,氨水中氢氧根离子浓度=$\frac{1{0}^{-14}}{1{0}^{b-14}}$mol/L=10-bmol/L,氨水为弱碱,则氨水的物质的量浓度大于10-bmol/L,盐酸为强酸,则pH=b的盐酸的浓度为10-bmol/L,两溶液等体积混合后氨水的物质的量大于硝酸的物质的量,混合液显示碱性,不会呈中性,故B错误;
C.碳酸氢钠溶液中,HCO3-的水解程度大于其电离程度,则c(H2CO3)>c(CO32-),正确的浓度大小为:c(HCO3-)>c(H2CO3)>c(CO32-),故C错误;
D.0.1mol/LCH3COOH溶液与0.05mol/LNaOH溶液等体积混合,反应后溶质为等浓度的醋酸和醋酸钠,根据电荷守恒可得c(CH3COO-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可得c(CH3COOH)+c(CH3COO-)=2c(Na+),二者结合可得:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中应用方法,试题培养了学生的分析、理解能力及灵活应用能力.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案| A. | 60g丙醇中存在的共价键总数为10NA | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 常温常压下,78g苯中含有碳碳双键的数目为3NA |
| A. | 标准状况下,64gCu与足量浓硝酸反应恰好生成2NA个NO2分子 | |
| B. | 120gNaHSO4固体中含有NA个阳离子 | |
| C. | Si-O键的键能大于Si-Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
| A. | NaCl溶液 | B. | AgNO3溶液 | C. | HCl溶液 | D. | 稀Na2SO4溶液 |
| A. | 硫酸的摩尔质量是98 | |
| B. | 摩尔是阿伏加德罗常数个微粒的集合体 | |
| C. | 6.02Х1023就是阿伏加德罗常数 | |
| D. | 氧气的摩尔质量(单位:g•mol-1)在数值上等于它的相对分子质量 |
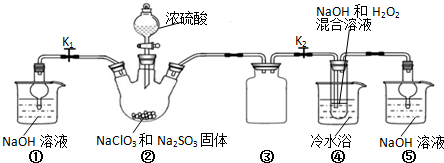
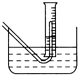 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验: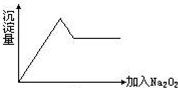 一无色透明的溶液做如下实验:
一无色透明的溶液做如下实验: