题目内容
3.若电解饱和食盐水时消耗NaCl 117g,计算理论上最多可配成物质的量浓度为0.5mol•L-1的氢氧化钠溶液多少升?用该反应制得的氯制备漂白粉,最多能生成漂白粉的质量为多少?分析 根据消耗NaCl117g即$\frac{117g}{58.5g/mol}$=2mol结合电解反应2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑计算生成氢氧化钠和氯气的物质的量,再根据V=$\frac{n}{c}$计算氢氧化钠体积,根据2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O计算生成漂白粉的质量.
解答 解:设电解饱和食盐水时消耗NaCl 117g生成氢氧化钠 n1mol,氯气n2mol,最多能生成漂白粉的质量为mg;
则 2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑
117g 2mol 1mol
117g n1 n2
解得 n1=2mol,n2=1mol,
氢氧化钠溶液的体积:V=n1/C=2mol/(0.5mol•L-1)=4L
2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
2mol 254g
1mol m
2mol:254g=1mol:m 解得m=127g
答:最多可配成物质的量浓度为0.5mol•L-1的氢氧化钠溶液4L,最多能生成漂白粉的质量为127g.
点评 本题考查学生利用化学反应方程式的计算,明确发生的化学反应及物质的量的有关计算公式即可解答,题目难度不大

练习册系列答案
相关题目
8.糖类、油脂和蛋白质是生命活动所必需的营养物质.下列叙述正确的是( )
| A. | 植物油不能发生水解反应 | |
| B. | 棉花和蚕丝的主要成份都是纤维素 | |
| C. | 淀粉水解的最终产物是葡萄糖 | |
| D. | 蛋白质溶液中加重金属盐发生物理变化 |
18. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
1.00.50t(s)123c(mol/L)abcd
(1)已知升高温度,NO2的浓度减小,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b
用O2表示从0~2s内该反应的平均速率v=0.15mol/(L•s)
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 2.0 | 1.0 | 0.8 | 0.7 | 0.7 | 0.7 |
(1)已知升高温度,NO2的浓度减小,则该反应是放热反应.
(2)图中表示NO2的变化的曲线是b
用O2表示从0~2s内该反应的平均速率v=0.15mol/(L•s)
(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是c
a.及时分离除NO2气体 b.适当升高温度 c.增大O2的浓度 d.选择高效催化剂.
15.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | 食盐水 | B. | CO2 | C. | NaHCO3 | D. | 氢氧化钠 |
12.“绿色化学”是当今社会提出的一个新概念.在“绿色化学工艺中,理想状态是反应物中原子全部转化为欲制的产物,即原子的利用率为100%.在用丙炔合成甲基丙烯酸甲酯( )的过程中,欲使原子利用率达到最高,还需要其他的反应物是( )
| A. | CO和CH3OH | B. | CO2和H20 | C. | H2和CO2 | D. | CH3OH和H2 |
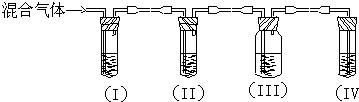
 、
、 、
、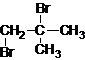 .
. .
.
 .(不用注明条件)
.(不用注明条件)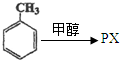
 .(不用注明条件)
.(不用注明条件) .
.