题目内容
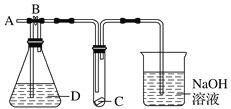
【题目】某课外研究性学习小组拟用粗盐(含有少量杂质包括:泥沙、CaCl2、MgCl2、Na2SO4)经提纯后,配制0.4mol/L 450mL NaCl溶液.他们设计并实施了如下实验,请根据已学过的知识回答下列问题:
(1)取一定量的粗盐置于烧杯中加适量的水溶解。将配制的粗盐悬浊液过滤后取滤液加入过量的除杂试剂,如果除杂试剂可从下列六种溶液中选择①Na2CO3溶液②KOH溶液③AgNO3溶液④NaOH溶液⑤NaHCO3溶液⑥BaCl2溶液,则正确的试剂和加入的顺序应为:__________(填选项)
A.①②③ B.②⑥⑤ C.④⑥① D.①④⑥ E.⑥①④ F.⑥②⑤
(2)将所得的悬浊液经过滤后取滤液加入足量的盐酸,充分反应后对混合溶液进行蒸发、过滤、洗涤、干燥操作,得到纯净的NaCl固体,请描述在蒸发操作过程中玻璃棒的作用:_______________________________________________________
(3)利用(2)中所得的NaCl固体继续配制所需溶液.在托盘天平上称量____g NaCl固体.配制过程中需要使用的玻璃仪器有:烧杯、玻璃棒、_________
和_______________
(4)配制结束后同学们对实验中出现的某些错误操作,对最终配制的溶液浓度的影响进行了分析,则下列错误操作会导致最终配制溶液中NaCl的浓度相比0.4mol/L是偏小的是__________
A.在上述(2)步中没有使用盐酸处理滤液;
B.在上述(3)步中没有对烧杯和玻璃棒进行洗涤;
C.定容时俯视凹液面;
D.上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线。
【答案】CE 搅拌,使溶液受热均匀 11.7g 胶头滴管 500mL容量瓶 AB
【解析】
(1)、根据含有的杂质是CaCl2、MgCl2、Na2SO4,根据既能除去杂质还不能引入新杂质的原则,选择出合适的除杂试剂是:①Na2CO3溶液④NaOH溶液⑥BaCl2溶液,然后根据①Na2CO3溶液的作用是不但要除去CaCl2,还要除去过量的BaCl2,故①Na2CO3溶液的加入一定要在⑥BaCl2溶液之后,得出所加试剂的顺序;
(2)、蒸发操作过程中为防止溶液因局部过热造成飞溅,需要用玻璃棒搅拌,使溶液受热均匀;
(3)、依据配制溶液体积选择合适容量瓶,依据m=cV M计算需要溶质的质量;根据配制步骤选择需要的仪器;
(4)、分析操作对溶质的物质的量和溶液体积的影响,依据![]() 进行误差分析。
进行误差分析。
(1)、除去食盐中的CaCl2用①Na2CO3溶液,除去MgCl2用④NaOH溶液,除去Na2SO4用⑥BaCl2溶液,而①Na2CO3溶液的作用是不但要除去CaCl2,还要除去过量的BaCl2,故①Na2CO3溶液的加入一定要在⑥BaCl2溶液之后,故正确的试剂和加入的顺序应为:⑥①④或⑥④①或④⑥①;
故选CE;
(2)、蒸发操作过程中为防止溶液因局部过热造成飞溅,需要用玻璃棒搅拌,使溶液受热均匀;
故答案为:搅拌,使溶液受热均匀;
(3)、配制0.4mol/ L 450mL NaCl溶液,应择500mL容量瓶,实际配制500mL溶液,需要溶质氯化钠的质量m = 0.4mol/L×58.5g/mol×0.5L= 11.7g ;配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,用到的仪器为:天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管;所以还需要的仪器为:胶头滴管; 500mL容量瓶;
故答案为:11.7;胶头滴管; 500mL 容量瓶;
(4)A、在上述(2)步中没有使用盐酸处理滤液,则得到的氯化钠中含有杂质,导致称取的氯化钠质量偏小,溶质的物质的量偏小,溶液浓度偏小;
B、在上述(3)步中没有对烧杯和玻璃棒进行洗涤,导致部分溶质未转移到容量瓶,导致浓度偏小;
C、定容时俯视凹液面,导致溶液体积偏小,溶液浓度偏大;
D、上下颠倒摇匀后液面低于刻度线,未及时加水至刻度线,操作正确,溶液浓度准确无影响;
故选AB。

 阅读快车系列答案
阅读快车系列答案