题目内容
【题目】NA为阿伏加德罗常数,下列叙述中正确的是
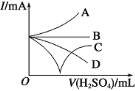
①106 g Na2CO3晶体中的离子总数大于3NA
②25 ℃、1.01×105 Pa下,14 g氮气所含的氮原子数为NA
③标准状况下,22.4LCCl4中所含的分子数约为6.02×1023
④标准状况下,aL的氧气和氮气的混合物含有的分子数约为![]() ×6.02×1023
×6.02×1023
⑤常温常压下,92 g的NO2和N2O4混合气体含有的原子数为6NA
A.①②④B.②④⑤C.③④⑤D.④⑤
【答案】B
【解析】
①106 g Na2CO3晶体的物质的量为1mol,离子总数为3NA,①错误;
②25 ℃、1.01×105 Pa下,14 g氮气的物质的量为0.5mol,氮气为双原子分子,则所含的氮原子数为NA,②正确;
③标准状况下,CCl4为液体,无法用气体摩尔体积计算22.4LCCl4的分子数,③错误;
④标准状况下,aL的氧气和氮气的混合物的物质的量为![]() mol,则含有的分子数约为
mol,则含有的分子数约为![]() ×6.02×1023,④正确;
×6.02×1023,④正确;
⑤常温常压下,NO2和N2O4的最简式都为NO2,则92 g的NO2和N2O4混合气体含有的原子数为![]() =6NA,⑤正确;
=6NA,⑤正确;
综上所述,答案为B。

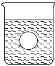
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:

可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。