题目内容
【题目】如图所示物质相互转换关系:

试回答:
(1)写出B的化学式____________、C溶液是______________。
(2)写出由E转变成F发生反应的化学方程式_______________。
(3)鉴别G溶液中阳离子的操作方法及实验现象:__________________。
(4)向G溶液中加入A的离子方程式____________________。
(5)写出D溶液中加入AgNO3得到白色沉淀的离子方程式__________________。
【答案】FeCl2 KOH 4Fe(OH)2+2H2O+O2=4Fe(OH)3 取G溶液少许与试管中,滴加KSCN若变红则阳离子是Fe3+ 2Fe3++Fe=3Fe2+ Ag++Cl-=AgCl↓
【解析】
D与硝酸银、稀硝酸反应得到的溶液,进行焰色反应显紫色,说明D溶液中含有K元素,D能和硝酸银溶液反应生成白色沉淀H,H为AgCl,所以D为KCl;白色沉淀E在空气中转化为红褐色沉淀F,则E为Fe(OH)2、F为Fe(OH)3;氢氧化铁被盐酸溶解生成溶液G,G为FeCl3;B和C反应生成氯化钾和氢氧化亚铁,所以B、C分别是氢氧化钾、氯化亚铁中的一种,G能和A反应生成B,所以A是Fe,则B是FeCl2,C是KOH,Fe与盐酸反应得到氯化亚铁与氢气,据此分析解答。
根据上述分析,A是Fe,B是FeCl2,C是KOH,D是KCl,E为Fe(OH)2,F为Fe(OH)3,G为FeCl3,H为AgCl,I为KNO3。
(1)B为FeCl2,C为KOH,故答案为:FeCl2;KOH;
(2)氢氧化亚铁被空气中的氧气氧化生成氢氧化铁的化学方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G为FeCl3溶液,鉴别G溶液中阳离子Fe3+的方法较多,主要有:①加碱有红褐色沉淀生成;②加KSCN溶液后溶液呈红色;③加苯酚呈紫色。常用KSCN溶液鉴别Fe3+,方法是:取少许G溶液于试管中,滴加KSCN溶液,溶液呈红色即可鉴别含Fe3+,故答案为:取G溶液少许与试管中,滴加KSCN若变红则阳离子是Fe3+;
(4)向氯化铁溶液加入Fe的离子反应方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(5)KCl溶液与AgNO3溶液反应的离子方程式:Ag++Cl-=AgCl↓;故答案为:Ag++Cl-=AgCl↓。

【题目】三硫代碳酸钠(Na2CS3)常用作杀菌剂、沉淀剂。某小组设计实验探究三硫代碳酸钠的性质并测定其溶液的浓度。
实验1:探究Na2CS3的性质
步骤 | 操作及现象 |
① | 取少量Na2CS3 固体溶于蒸馏水配制成溶液并分成两等份 |
② | 向其中一份溶液中滴加几滴酚酞试液,溶液变红色 |
③ | 向另一份溶液中滴加酸性KMnO4溶液,紫色褪去 |
(1)H2CS3是________酸(填“强”或“弱”)。
(2)已知步骤③的氧化产物是SO42-,写出该反应的离子方程式________________________。
实验2:测定Na2CS3溶液的浓度,按如图所示连接好装置,取100mLNa2CS3溶液置于三颈烧瓶中,打开仪器d的活塞,滴入足量2.0mol/L稀H2SO4,关闭活塞。
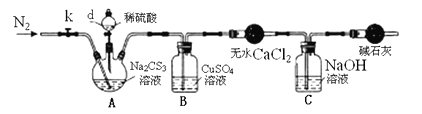
已知:Na2CS3 + H2SO4=Na2SO4 + CS2 + H2S↑。CS2和H2S均有毒。CS2不溶于水,沸点46℃,与CO2某些性质相似,与NaOH作用生成Na2COS2和H2O。
(3)盛放无水CaCl2的仪器的名称是____________。
(4)反应结束后打开活塞k,再缓慢通入热N2一段时间,其目的是___________________。
(5)为了计算Na2CS3溶液的浓度,对B中混合物进行过滤、洗涤、干燥、称重,得19.2g固体,则A中Na2CS3的物质的量浓度为____________________。
(6)分析上述实验方案,还可以通过测定C中溶液质量的增加值来计算Na2CS3溶液的浓度,若反应结束后将通热N2改为通热空气,计算值________(填“偏高”、“偏低”或“无影响”)。