题目内容
【题目】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:
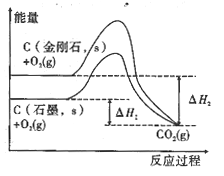
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为___。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为___。(已知H2CO3 的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为___。
(4)COS的水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:

①该反应的最佳条件为:投料比[n(H2O)/n(COS)]=___,温度___。
②P点对应的平衡常数为___。(保留小数点后2位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是___。
【答案】2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-632kJ·mol-1 1.0×103 COS+4H2O2=CO2↑+H2SO4+3H2O 10:1 160℃ 0.05 催化剂活性降低,反应速率变慢;该反应正反应为放热反应,升高温度平衡向逆反应方向移动
【解析】
(1)应用盖斯定律,(①![]() 2+②)
2+②)![]() 3得,2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=[(-362kJ/mol)
3得,2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=[(-362kJ/mol)![]() 2+(-1172kJ/mol)]
2+(-1172kJ/mol)]![]() 3=-632kJ/mol;
3=-632kJ/mol;
(2)反应K2CO3+H2S=KHS+KHCO3的离子方程式为CO32-+H2S=HS-+HCO3-,该反应的平衡常数K=  =
= 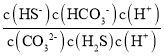 =
=![]() ;
;
(3)在强酸溶液中H2O2将COS氧化为H2SO4,同时生成CO2,H2O2被还原,该反应的化学方程式为4H2O2+COS=H2SO4+CO2↑+3H2O;
(4)①根据图1,随着![]() 的增大,COS的平衡转化率增大,当
的增大,COS的平衡转化率增大,当![]()
![]() 10:1,COS的平衡转化率增大不明显,反应的投料比最佳为
10:1,COS的平衡转化率增大不明显,反应的投料比最佳为![]() =10:1;根据图2,一定时间内COS的水解转化率在160℃时最大,反应的最佳温度为160℃;
=10:1;根据图2,一定时间内COS的水解转化率在160℃时最大,反应的最佳温度为160℃;
②P点![]() =6,平衡时COS的转化率为40%,设起始c(COS)=amol/L,则起始c(H2O)=6amol/L,用三段式可以求得;
=6,平衡时COS的转化率为40%,设起始c(COS)=amol/L,则起始c(H2O)=6amol/L,用三段式可以求得;
③当温度升高到一定值后,发现一定时间内COS的水解转化率降低,可能原因是:催化剂活性降低,反应速率变慢;该反应正反应为放热反应,升高温度平衡向逆反应方向移动。
(1)应用盖斯定律,(①![]() 2+②)
2+②)![]() 3得,2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=[(-362kJ/mol)
3得,2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=[(-362kJ/mol)![]() 2+(-1172kJ/mol)]
2+(-1172kJ/mol)]![]() 3=-632kJ/mol,H2S气体和氧气反应生成固态硫和液态水的热化学方程式为:2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=-632kJ/mol;
3=-632kJ/mol,H2S气体和氧气反应生成固态硫和液态水的热化学方程式为:2H2S(g)+O2(g)=2S(s)+2H2O(l)ΔH=-632kJ/mol;
(2)反应K2CO3+H2S=KHS+KHCO3的离子方程式为CO32-+H2S=HS-+HCO3-,该反应的平衡常数K=  =
= 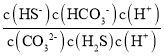 =
=![]() =
=![]() =1
=1![]() 103;
103;
(3)在强酸溶液中H2O2将COS氧化为H2SO4,同时生成CO2,H2O2被还原,该反应的化学方程式为4H2O2+COS=H2SO4+CO2↑+3H2O;
(4)①根据图1,随着![]() 的增大,COS的平衡转化率增大,当
的增大,COS的平衡转化率增大,当![]()
![]() 10:1,COS的平衡转化率增大不明显,反应的投料比最佳为
10:1,COS的平衡转化率增大不明显,反应的投料比最佳为![]() =10:1;根据图2,一定时间内COS的水解转化率在160℃时最大,反应的最佳温度为160℃;
=10:1;根据图2,一定时间内COS的水解转化率在160℃时最大,反应的最佳温度为160℃;
②P点![]() =6,平衡时COS的转化率为40%,设起始c(COS)=amol/L,则起始c(H2O)=6amol/L,用三段式
=6,平衡时COS的转化率为40%,设起始c(COS)=amol/L,则起始c(H2O)=6amol/L,用三段式
COS(g)+H2O(g)![]() CO2(g)+H2S(g)
CO2(g)+H2S(g)
c(起始)(mol/L) a 6a 0 0
c(转化)(mol/L)0.4a 0.4a 0.4a 0.4a
c(平衡)(mol/L)0.6a 5.6a 0.4a 0.4a
P点对应的平衡常数K= ![]() =
=![]() =0.05;
=0.05;
③当温度升高到一定值后,发现一定时间内COS的水解转化率降低,可能原因是:催化剂活性降低,反应速率变慢;该反应正反应为放热反应,升高温度平衡向逆反应方向移动。

 阅读快车系列答案
阅读快车系列答案