题目内容
【题目】下列过程都与热量变化有关,其中叙述正确的是
A.Ba(OH)2·8H2O与NH4Cl常温下混合就能反应,故该反应放热
B.已知2H2(g)+O2(g)=2H2O(g)ΔH=-483.6kJ·mol–1,故H2的燃烧热为241.8kJ·mol–1
C.已知H+-(aq)+OH-(aq)==H2O-(l)ΔH=-57.31kJ·mol–1,故Ba2+(aq)+H+(aq)+OH-(aq)+SO42-(aq)=H2O(1)+BaSO4(s)ΔH<-57.31kJ·mol–1
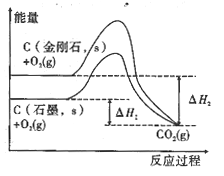
D.由图可知,反应C(金刚石,s)=C(石墨,s)的焓变ΔH=ΔH1-ΔH2
【答案】C
【解析】
试题分析:A.化学反应是吸热反应还是放热反应与反应条件无关,Ba(OH)28H2O与NH4Cl属于吸热反应,但常温下混合就能反应,故A错误;B.燃烧热是指1mol可燃物充分燃烧生成稳定的氧化物时放出的热量,而该方程式中水为液态,所以H2的燃烧热应大于241.8 kJ·mol–1,故B错误;C.已知 H+-(aq)+OH-(aq)==H2O-(l) ΔH=-57.31 kJ·mol–1,由于在反应Ba2+(aq) + H+(aq) + OH- (aq) + SO42- (aq)= H2O(1) + BaSO4(s)中生成时也会放出热量,所以该反应ΔH<-57.31 kJ·mol–1,故C正确;D.由图4可知,反应C(金刚石,s) =C(石墨,s)的焓变ΔH =ΔH2-ΔH1,故D错误。故选C。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目

