题目内容
【题目】肼(N2H4)碱性燃料电池的原理示意图如图所示,电池总反应为:N2H4+O2=N2+2H2O。下列说法错误的是( )
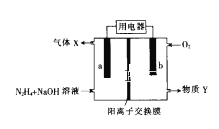
A.电极b发生氧化反应
B.电流由电极b流出经用电器流入电极a
C.物质Y是NaOH溶液
D.电极a的电极反应式为:N2H4+4OH--4e-=N2↑+4H2O
【答案】A
【解析】
A. 电极b处通入氧气,电极方程式为:O2+2H2O+4e-=4OH-,发生还原反应,是正极,故A错误;
B. 电极b处通入氧气,发生还原反应,是正极,电极a为负极,电流由正极流向负极,故B正确;
C. 肼(N2H4)一空气燃料电池中,负极反应为:N2H4+4OH--4e-=4H2O+N2↑,正极反应为:O2+2H2O+4e-=4OH-,电极b处产生OH-,所以物质Y是NaOH,故C正确;
D. 电极a处产生N2,发生氧化反应,电极方程式为:N2H4+4OH--4e-=4H2O+N2↑,故D正确;
题目要求选择错误选项,故选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】25℃时,用浓度为0.100 0 mol·L-1的氢氧化钠溶液分别滴定20.00 mL浓度均为0.100 0 mol·L-1的二种酸HX、HY(忽略体积变化),实验数据如下表,下列判断不正确的是 ( )
数据编号 | 滴入NaOH(aq)的体积/mL | 溶液的pH | |
HX | HY | ||
① | 0 | 3 | 1 |
② | a | 7 | x |
③ | 20.00 | >7 | y |
A. 在相同温度下,同浓度的两种酸溶液的导电能力:HX<HY
B. 由表中数据可估算出Ka(HX)≈10-5
C. HY和HX混合,c(H+)=c(X-)+c(Y-)+c(OH-)
D. 上述②反应后的HY溶液中:c(Na+)>c(Y-)>c(OH-)>c(H+)