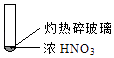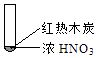题目内容
【题目】按要求进行计算,直接写出计算结果:
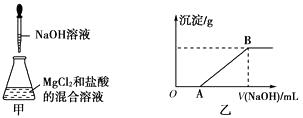
(1)标准状况下,2.24L Cl2的质量为g.
(2)10.8g R2O5中氧原子的数目为3.01×1023 , 则元素R的相对原子质量为 .
(3)阻燃剂碱式碳酸铝镁中OH﹣与CO32﹣质量之比为51:300,则这两种离子的物质的量之比为 .
(4)将10mL1.00mol/L Na2CO3溶液与10mL1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为mol/L(忽略混合前后溶液体积的变化).
【答案】
(1)7.1
(2)14
(3)3:5
(4)1.00
【解析】解:(1)标准状况下,2.24L Cl2的质量为: ![]() ×71g/mol=7.1g;
×71g/mol=7.1g;
所以答案是:7.1;(2)设元素R的相对原子质量为a,则10.8g R2O5中氧原子的数目为: ![]() ×5×6.02×1023=3.01×1023,解答a=14,
×5×6.02×1023=3.01×1023,解答a=14,
所以答案是:14;(3)设阻燃剂碱式碳酸铝镁中OH﹣与CO32﹣质量分别为51g:300g,则二者物质的量之比为: ![]() :
: ![]() =3:5;
=3:5;
所以答案是:3:5;(4)将10mL1.00mol/L Na2CO3溶液与10mL1.00mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为: ![]() =1.00mol/L;
=1.00mol/L;
所以答案是:1.00.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案【题目】根据实验内容填空:
(1)甲同学利用下列装置来进行铜跟浓硫酸反应实验. 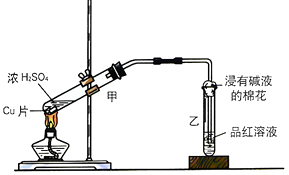
①写出甲装置中发生的主要反应的化学方程式 .
②乙同学认为,若要用铜制取硫酸铜,可以先用铜和氧气反应生成氧化铜,然后利用氧化铜和稀硫酸反应可以得到硫酸铜.若要制取硫酸铜,请你从环境保护和节约资源的角度分析,比较甲同学和乙同学制取硫酸铜的方法中更合理的是 , 原因是 . 
(2)丙同学利用下图的方法实验室制取并验证SO2某些性质,并将实验情况记录在表中,请完成以下表格:
装置序号 | 实验现象或作用 | 实验结论或化学方程式 |
① | 有气泡产生 | 化学方程式为: |
② | 紫色石蕊试液变色 | 证明SO2溶于水显酸性 |
③ | 品红溶液褪色 | 证明SO2具有性 |
④ | 溶液变浑浊 | 证明SO2具有性 |
⑤ | 溴水褪色 | 证明SO2具有性 |
⑥ | 吸收尾气 | 证明SO2属于性氧化物 |
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 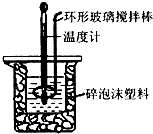
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪器除胶头滴管外还要;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为J[中和后生成的溶液的比热容c=4.2J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)若用50mL 0.55molL﹣1的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会(填“偏大”、“偏大”或“不变”),其原因是 .
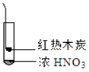
【题目】下述实验中均有红棕色气体产生,对比分析所的结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2 , 由此说明木炭一定与浓硝酸发生了反应