��Ŀ����
����Ŀ������ʵ��������գ�
��1����ͬѧ��������װ��������ͭ��Ũ���ᷴӦʵ�飮 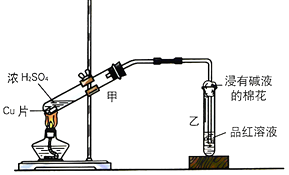
��д����װ���з�������Ҫ��Ӧ�Ļ�ѧ����ʽ ��
����ͬѧ��Ϊ����Ҫ��ͭ��ȡ����ͭ����������ͭ��������Ӧ��������ͭ��Ȼ����������ͭ��ϡ���ᷴӦ���Եõ�����ͭ����Ҫ��ȡ����ͭ������ӻ��������ͽ�Լ��Դ�ĽǶȷ������Ƚϼ�ͬѧ����ͬѧ��ȡ����ͭ�ķ����и��������� �� ԭ���� �� 
��2����ͬѧ������ͼ�ķ���ʵ������ȡ����֤SO2ijЩ���ʣ�����ʵ�������¼�ڱ��У���������±���
װ����� | ʵ����������� | ʵ����ۻ�ѧ����ʽ |
�� | �����ݲ��� | ��ѧ����ʽΪ�� |
�� | ��ɫʯ����Һ��ɫ | ֤��SO2����ˮ������ |
�� | Ʒ����Һ��ɫ | ֤��SO2������ |
�� | ��Һ����� | ֤��SO2������ |
�� | ��ˮ��ɫ | ֤��SO2������ |
�� | ����β�� | ֤��SO2������������ |
���𰸡�
��1��Cu+2H2SO4![]() CuSO4+SO2��+2H2O���ң����ж����������,��Ⱦ����,������Ⱦ,���������ʸ�
CuSO4+SO2��+2H2O���ң����ж����������,��Ⱦ����,������Ⱦ,���������ʸ�
��2��Na2SO3+H2SO4��Ũ��=Na2SO4+H2O+SO2�����죻Ư�ף���������ԭ����
���������⣺��1����ͭ��Ũ���ᷴӦ��������ͭ�Ͷ����������壬��Ӧ�Ļ�ѧ����ʽΪ��Cu+2H2SO4 ![]() CuSO4+SO2��+2H2O�����Դ��ǣ�Cu+2H2SO4
CuSO4+SO2��+2H2O�����Դ��ǣ�Cu+2H2SO4 ![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
�ڼ������ɶ���������������һ���ж����壬���Լ�������ȡ��ͨ�������֪������ͬ����������ͭ���ҷ������ĵ������٣��Ƚ�Լ��ԭ�ϣ��ֲ���Ⱦ������
���Դ��ǣ��ң����ж��������������Ⱦ������������Ⱦ�����������ʸߣ���2������Ϊ�������ƺ�Ũ���ᷴӦ���ɶ����������壬��Ӧ�Ļ�ѧ����ʽΪ��Na2SO3+H2SO4��Ũ��=Na2SO4+SO2��+H2O��
���Դ��ǣ�Na2SO3+H2SO4��Ũ��=Na2SO4+H2O+SO2����
������������ˮ��ˮ��Ӧ���������ᣬ������Ϊ���ᣬ����ʹ��ɫʯ����Һ��죬
���Դ��ǣ���ɫ��
�۶���������Ʒ�컯��������ɫ���ʣ���ʹƷ����Һ��ɫ���ʶ����������Ư���ԣ�
���Դ��ǣ�Ư���ԣ�
��SO2��+4��S���������ԣ������Щ�2��S���л�ԭ�ԣ����������ܰ����������ɵ�����������ԭ�ɵ�����Ӧ����ʽΪSO2+2H2S=3S��+2H20��
���Դ��ǣ�������
�ݶ���������л�ԭ�ԣ��ܹ�����ˮ����������ԭ��Ӧ��������������ᣬ��ˮ��ɫ��
���Դ��ǣ���ԭ��
���������ж�������ֱ���ŷŵ������У��������������������ܹ����������Ʒ�Ӧ�����������ƺ�ˮ�����Դ��ǣ��ᣮ

����Ŀ��ijͬѧ��ʵ�����н�������ʵ�飺
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | û�����Ա仯����Һ��Ϊ��ɫ | �а�ɫ�������ɣ���ҺΪ��ɫ | ����ɫ����ų� |
���½�����ȷ����( )
A.���������Ա仯��˵������Һ����Ӧ
B.���еİ�ɫ����ΪCuCl2
C.���е����ӷ���ʽΪ2H����Zn=Zn2����H2��
D.���з����ķ�Ӧ�������ӷ�Ӧ