题目内容
已知KMnO4、MnO2在酸性条件下均能将草酸钠(Na2C2O4)氧化: MnO4-+C2O42-+H+→Mn2++CO2↑+H2O(未配平) MnO2+C2O42-+4H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液全部转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.0200mol·L-1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应。试回答下列问题:
⑴配平: MnO4-+ C2O42-+ H+― Mn2++ CO2↑+ H2O
⑵0.0200mol·L-1KMnO4标准溶液应置于 (选填“甲”或“乙”)滴定管中;判断滴定终点的依据是 ;
⑶你能否帮助该研究小组求得软锰矿中MnO2的质量分数 (选填“能”或“否”)。若回答“能”,请给出计算结果;若回答“否”,试说明原因 ;
⑷若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 。
A.滴定前尖嘴部分有一气泡,滴定终点时消失;B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤;C.滴定前仰视读数,滴定后俯视读数;D.定容时,俯视刻度线;E.锥形瓶水洗之后未用待测液润洗。
⑴2 5 16 2 10 8
⑵甲 当看到加入1滴KMnO4溶液,锥形瓶中溶液立即变成紫红色,且半分钟内不褪色,即达到滴定终点
⑶否 因为不知道容量瓶的规格 ⑷AD

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
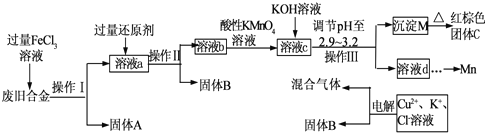
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
| 开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
| 沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
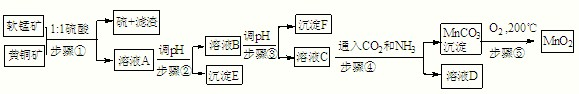
(1)“废渣1”的主要成分是
(2)完成“反应器2”中反应之一的离子方程式:
(3)蘸取“反应器2”中的溶液点在
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ?mol-1
C(s)+CO2(g)=2CO(g)△H=+283.0kJ?mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式:
(5)“反应器3”中加入锌粉的作用是
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO2 0.224L,碱式碳酸锌的化学式为