题目内容
活性氧化锌常用作橡胶制品的硫化活性剂.工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)生产活性氧化锌,生产工艺流程如下: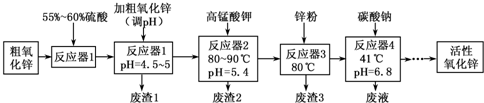
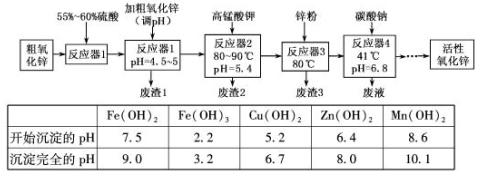
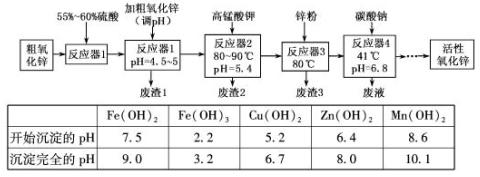
| Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | Zn(OH)2 | Mn(OH)2 | |
| 开始沉淀的pH | 7.5 | 2.2 | 5.2 | 6.4 | 8.6 |
| 沉淀完全的pH | 9.0 | 3.2 | 6.7 | 8.0 | 10.1 |
(1)“废渣1”的主要成分是
(2)完成“反应器2”中反应之一的离子方程式:
(3)蘸取“反应器2”中的溶液点在
(4)“废渣2”分离出的MnO2可用于制取MnO,已知:
2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ?mol-1
C(s)+CO2(g)=2CO(g)△H=+283.0kJ?mol-1
试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式:
(5)“反应器3”中加入锌粉的作用是
(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有
(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO2 0.224L,碱式碳酸锌的化学式为
分析:(1)PH值在4.5~5时,沉淀的只有铁离子,PH值大于3.2时铁离子沉淀完全;
(2)根据化合价升降相等、电荷守恒和原子守恒作答;
(3)高锰酸钾可以把碘离子氧化为碘单质,淀粉遇碘变蓝色;
(4)首先根据氧化还原关系写出化学方程式并标明状态,根据盖斯定律求焓变;
(5)通过前面的操作除掉了Fe3+、Fe2+、Mn2+,加入锌粒是为了除掉Cu2+;
(6)“反应器4”得到的废液中还含有酸溶时引入的硫酸根离子,加高锰酸钾引入的钾离子;
(7)由质量求出ZnO、CO2、H2O的物质的量,根据物质的量的比得碱式碳酸锌的化学式.
(2)根据化合价升降相等、电荷守恒和原子守恒作答;
(3)高锰酸钾可以把碘离子氧化为碘单质,淀粉遇碘变蓝色;
(4)首先根据氧化还原关系写出化学方程式并标明状态,根据盖斯定律求焓变;
(5)通过前面的操作除掉了Fe3+、Fe2+、Mn2+,加入锌粒是为了除掉Cu2+;
(6)“反应器4”得到的废液中还含有酸溶时引入的硫酸根离子,加高锰酸钾引入的钾离子;
(7)由质量求出ZnO、CO2、H2O的物质的量,根据物质的量的比得碱式碳酸锌的化学式.
解答:解:由表格可知:PH值在4.5~5时,沉淀的只有铁离子,PH值大于3.2时铁离子沉淀完全,因此废渣1的主要成分是氢氧化铁,
故答案为:Fe(OH)3;
(2)MnO 4-→MnO2,Mn化合价由+7→+4,化合价降低3,Mn2+→MnO2,Mn化合价由+2→+4,化合价升高2,根据化合价升降相等,MnO4-的化学计量数为2、
Mn2+化学计量数为3,依据电荷守恒,氢离子的化学计量数为4,根据Mn原子守恒,MnO2的化学计量数为5,根据原子守恒可知反应物还含有2H2O,综上可得离子方程式为:2 MnO4ˉ+3 Mn2++2 H2O=5 MnO2↓+4 H+,
故答案为:2;3;2H2O;5;4;
(3)高锰酸钾可以把碘离子氧化为碘单质,淀粉遇碘变蓝色,因此试纸为淀粉KI试纸,
故答案为:淀粉碘化钾;
(4)MnO2(s)与CO(g)反应制取MnO(s),Mn的化合价降低,因此CO中C的化合价升高,因此产物之一为二氧化碳,由此可得所求热化学方程式为:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H ③,设:2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ?mol-1 ①,C(s)+CO2(g)=2CO(g)△H=+283.0kJ?mol-1 ②,根据盖斯定律可知(①-②)×
=③,△H=
×(-174.6kJ?mol-1-283.0kJ?mol-1)=-228.8 kJ?mol-1,
故答案为:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H=-228.8 kJ?mol-1;
(5)通过前面的操作除掉了Fe3+、Fe2+、Mn2+,锌粒能置换出溶液中的Cu2+而把Cu2+除掉,
故答案为:除去Cu2+;
(6)“反应器4”得到的废液中含有的主要离子除了Na+外,还含有酸溶时引入的硫酸根离子,加高锰酸钾引入的钾离子,
故答案为:K+、SO42ˉ;
(7)标准状况下0.224L CO2 的物质的量为n(CO2)=
=0.01mol,CO2 的质量为m(CO2)=0.01mol×44g/mol=0.44g;则水的质量为:m(H2O)=3.41g-2.43g-0.44g=0.54g,水的物质的量为:n(H2O)=
=0.03mol;ZnO的物质的量为:n(ZnO)=
=0.03mol,综上可得:n(ZnO):n(CO2):n(H2O)=3:1:3,碱式碳酸锌的组成可表示为:3ZnO?CO2?3H2O,因此碱式碳酸锌的化学式为:ZnCO3?2Zn(OH)2?H2O或Zn3(OH)4CO3?H2O,
故答案为:ZnCO3?2Zn(OH)2?H2O或Zn3(OH)4CO3?H2O.
故答案为:Fe(OH)3;
(2)MnO 4-→MnO2,Mn化合价由+7→+4,化合价降低3,Mn2+→MnO2,Mn化合价由+2→+4,化合价升高2,根据化合价升降相等,MnO4-的化学计量数为2、
Mn2+化学计量数为3,依据电荷守恒,氢离子的化学计量数为4,根据Mn原子守恒,MnO2的化学计量数为5,根据原子守恒可知反应物还含有2H2O,综上可得离子方程式为:2 MnO4ˉ+3 Mn2++2 H2O=5 MnO2↓+4 H+,
故答案为:2;3;2H2O;5;4;
(3)高锰酸钾可以把碘离子氧化为碘单质,淀粉遇碘变蓝色,因此试纸为淀粉KI试纸,
故答案为:淀粉碘化钾;
(4)MnO2(s)与CO(g)反应制取MnO(s),Mn的化合价降低,因此CO中C的化合价升高,因此产物之一为二氧化碳,由此可得所求热化学方程式为:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H ③,设:2MnO2(s)+C(s)=2MnO(s)+CO2(g)△H=-174.6kJ?mol-1 ①,C(s)+CO2(g)=2CO(g)△H=+283.0kJ?mol-1 ②,根据盖斯定律可知(①-②)×
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:MnO2(s)+CO(g)=MnO(s)+CO2(g)△H=-228.8 kJ?mol-1;
(5)通过前面的操作除掉了Fe3+、Fe2+、Mn2+,锌粒能置换出溶液中的Cu2+而把Cu2+除掉,
故答案为:除去Cu2+;
(6)“反应器4”得到的废液中含有的主要离子除了Na+外,还含有酸溶时引入的硫酸根离子,加高锰酸钾引入的钾离子,
故答案为:K+、SO42ˉ;
(7)标准状况下0.224L CO2 的物质的量为n(CO2)=
| 0.224L |
| 22.4L/mol |
| 0.54g |
| 18g/mol |
| 2.43g |
| 81g/mol |
故答案为:ZnCO3?2Zn(OH)2?H2O或Zn3(OH)4CO3?H2O.
点评:本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息,其中计算是易失分点,本题难度中等.

练习册系列答案
相关题目




 -1
-1 重,得到ZnO 2.43g和标准状况下CO20.224l,碱式碳酸锌的化学式
重,得到ZnO 2.43g和标准状况下CO20.224l,碱式碳酸锌的化学式