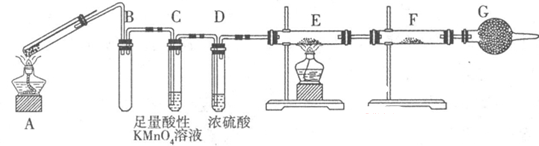
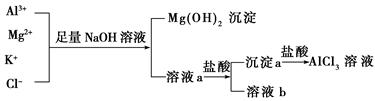
题目内容
LiBH4为近年来储氢材料领域的研究热点。
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为 mol。
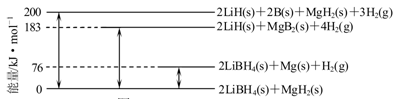
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H= 。
(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是 (填字母)。
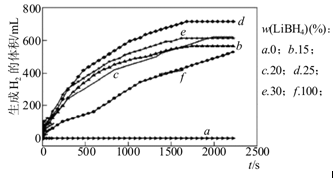
a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。
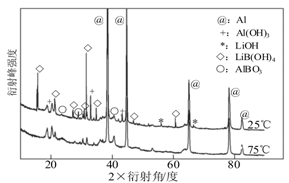
从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式),产生Al(OH)3的化学方程式为 。
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH (填“增大”、“减小”或“不变”),负极的电极反应式为 。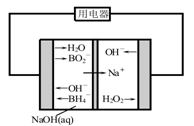
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为 mol。
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H= 。

(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是 (填字母)。

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。

从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是 (填化学式),产生Al(OH)3的化学方程式为 。
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH (填“增大”、“减小”或“不变”),负极的电极反应式为 。

(1)2(2分)
(2)-93 kJ·mol-1(2分)
(3)①ab(2分)
②LiBH4(2分) 2Al+6H2O=2Al(OH)3+3H2↑(2分)
(4)增大(2分) BH4--8e-+8OH-=BO2-+6H2O(2分)
试题分析:(1)LiBH4中氢元素化合价为-1价,生成1mol氢气电子转移2mol;(2)能量由上到下分别为1、2、3、4,则该反应的焓变为-(1+3-2-4)= -93 kJ·mol-1;(3)①a、图中当全为铝时气体为0,故纯铝与水不反应,正确;b、f线代表纯LiBH4与水反应产生氢气,正确;c、当材料含LiBH4为25%时(d线),产生氢气的量最多,错误。②由图12得出反应后已没有LiBH4,但存在大量铝,故其完全反应,;铝部分反应(有氢氧化铝等铝的产物);(4)右室双氧水得到电子为正极,电极反应式为H2O2+2e-=2OH-,故该极碱性增强,负极为BH4--8e-+8OH-=BO2-+6H2O。

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目