题目内容
6.已知丙烷的燃烧热△H=-2215kJ•mol-1.若一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为( )| A. | 55kJ | B. | 220kJ | C. | 550kJ | D. | 1108kJ |
分析 已知丙烷的燃烧热△H=-2215kJ•mol-1,则丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215kJ•mol-1,根据生成水的质量计算放出的热量.
解答 解:已知丙烷的燃烧热△H=-2215kJ•mol-1,则丙烷燃烧的热化学方程式为C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2215kJ•mol-1,
一定量的丙烷完全燃烧后生成1.8g水,则放出的热量约为$\frac{2215kJ×1.8g}{4×18g}$=55.375kJ≈55kJ;
故选:A.
点评 本题考查了燃烧热的概念、反应热的计算,题目难度不大,注意把握燃烧热的概念即1mol纯物质完全燃烧生成稳定氧化物放出的热量.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,4.4 g乙醛所含σ键数目为0.7NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
1.室温下向10mL 0.1 mol•L-1NaOH溶液中加入0.1mol•L-1的一元酸HA溶液pH的变化曲线如图所示.下列说法正确的是( )
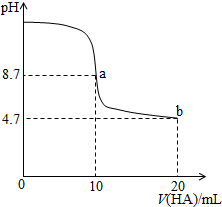

| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度相同 | |
| C. | pH=7时,c(Na+)=c(A-)+c(HA) | |
| D. | b点所示溶液中c(A-)>c(HA) |
11.下列指定微粒的数目相等的是( )
| A. | 等物质的量的水与重水含有的中子数 | |
| B. | 等质量的乙烯和丙烯中含有的共有电子对数 | |
| C. | 同温、同压、同体积的CO和NO含有的质子数 | |
| D. | 等物质的量的铁和铝分别与足量氯气完全反应时转移的电子数 |
18.下列有机物的命名错误的是( )
| A. | 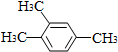 1,2,4-三甲苯 | B. | 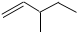 3-甲基戊烯 | C. | 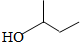 2-甲基-1-丙醇 | D. |  1,3-二溴丙烷 |
15.下列说法正确的是( )
| A. | 分子式为C2H6O的有机化合物性质相同 | |
| B. | 相同条件下,等质量的碳按a、b两种途径完全转化,途径a比途径b放出更多热能 途径a:C$→_{高温}^{H_{2}O}$CO+H2$→_{燃烧}^{O_{2}}$CO2+H2O 途径b:C$→_{燃烧}^{O_{2}}$CO2 | |
| C. | 在氧化还原反应中,还原剂失去电子总数等于氧化剂得到电子的总数 | |
| D. | 通过化学变化可以直接将水转变为汽油 |


 ,C
,C .
. .
. .
. 含苯环的所有同分异构体的结构简式:
含苯环的所有同分异构体的结构简式: .
.