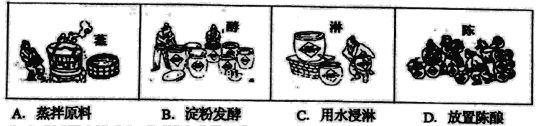
题目内容
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图。又知AgCl的Ksp=1.8×10-10。下列说法不正确

A.t°C时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t°C时,Y点和Z点的Ag2CrO4的Ksp相等
D.t°C时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
【答案】A
【解析】
A、根据图像,Ksp=c2(Ag+)×c(CrO42-)=(1×10-3)2mol·L-1×1×10-5mol·L-1=1×10-11,故A说法错误;
B、Ag2CrO4的溶解平衡:Ag2CrO4(s)![]() 2Ag+(aq)+CrO42-(aq),加入K2CrO4,溶液中c(CrO42-)增大,c(Ag+)降低,即Y点不变为X点,故B说法正确;
2Ag+(aq)+CrO42-(aq),加入K2CrO4,溶液中c(CrO42-)增大,c(Ag+)降低,即Y点不变为X点,故B说法正确;
C、溶度积只受温度的影响,Y和Z点温度相同,溶度积相等,故C说法正确;
D、如果生成AgCl沉淀,需要c(Ag+)=![]() =1.8×10-8mol·L-1,如果生成Ag2CrO4,需要c(Ag+)=
=1.8×10-8mol·L-1,如果生成Ag2CrO4,需要c(Ag+)= ![]() =
=![]() ×10-4mol·L-1,因此先析出氯化银沉淀,故D说法正确;
×10-4mol·L-1,因此先析出氯化银沉淀,故D说法正确;
答案选A。

【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如下。
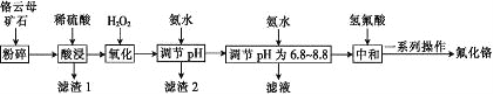
下表列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)将铬云母矿石粉碎的目的是___________。
(2)Cr2O3与稀硫酸反应的化学方程式为________________。
(3)第一次滴加氨水调节pH范围为______。
(4)第二次滴加氨水调节pH 为6.8~8.8的目的是___________,Cr(OH)3与 Al(OH)3 一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:___________。