题目内容
8. 碳、氢、氧 3 种元素组成的有机物A,相对分子质量为 102,含氢的质量分数为9.8%,分子中氢原子个数为氧的 5 倍.
碳、氢、氧 3 种元素组成的有机物A,相对分子质量为 102,含氢的质量分数为9.8%,分子中氢原子个数为氧的 5 倍. (1)A的分子式是C5H10O2.
(2)A有 2个不同的含氧官能团,其名称是羟基、醛基.
(3)一定条件下,A 与氢气反应生成 B,B 分子的结构可视为 1 个碳原子上连接 2 个甲基和另外2 个结构相同的基团.则A 可以发生的反应是(填写序号字母)cd.
a.加聚反应 b.消去反应 c.酯化反应 d.还原反应
(4)写出一个与A 具有相同官能团,不带有支链的同分异构体的结构简式:
 .
.(5)A 的一种酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是CH3COOCH(CH3)2+H2O$→_{加热}^{无机酸}$CH3COOH+(CH3)2CH-OH.
(6)已知环氧氯丙烷可与乙二醇发生如下聚合反应:
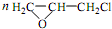 +CH2Cl+nOHCH2CH2OH$\stackrel{一定条件}{→}$
+CH2Cl+nOHCH2CH2OH$\stackrel{一定条件}{→}$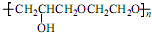 +nHCl
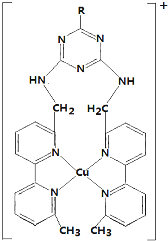
+nHClB 也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是.
分析 (1)根据相对分子质量和含氢量可计算一个分子中含有的H原子个数,根据分子中氢原子个数为氧个数的5倍可计算O原子个数,最后根据相对分子质量计算C原子个数,即可求得分子式;
(2)根据含氧官能团的种类分析;
(3)根据分子式结合有机物的结构判断;根据有机物含有的官能团判断可能具有的性质.
(4)根据A的结构、碳链异构和位置异构来写结构简式;
(5)根据酯类水解得到酸和醇来书写方程式;
(6)根据反应信息确定有机物断键与成键的位置,结合B的结构进行书写.
解答 解:(1):相对分子质量为102,含氢的质量分数为9.8%,则分子中含有的N(H)=$\frac{102×9.8%}{1}$=10,
分子中氢原子个数为氧个数的5倍,则N(O)=2,
N(C)=$\frac{102-10-16×2}{12}$=5,
所以分子式为C5H10O2,故答案为:C5H10O2;
(2)分子式为C5H10O2的有机物可能为酸、酯,如果有两个含氧官能团的话,可能为羰基和羟基,故答案为:羟基、羰基;
(3)一定条件下,A与一定氢气反应生成B,B分子的结构可视为一个碳原子上连接两个甲基和另外两个结构相同的基团,则B为 ,反应为
,反应为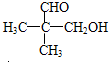 →
→ ,则A为
,则A为 ,A中含有-CHO,能发生还原反应,含有-OH,能发生取代、酯化反应,由于相邻C原子上没有H原子,则不能发生消去反应,故答案为:cd;
,A中含有-CHO,能发生还原反应,含有-OH,能发生取代、酯化反应,由于相邻C原子上没有H原子,则不能发生消去反应,故答案为:cd;
(4)因A具中含有-CHO,-OH、相同官能团、并带有支链的同分异构体的结构简式为: 、
、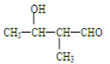 ;
;
故答案为 (
( );
);
(5)因酯类水解得到酸和醇,所以CH3COOCH(CH3)2+H2O$→_{加热}^{无机酸}$CH3COOH+(CH3)2CH-OH,故答案为:CH3COOCH(CH3)2+H2O$→_{加热}^{无机酸}$CH3COOH+(CH3)2CH-OH;
(6) 与环氧氯丙烷发生反应生成高聚物的结构简式为
与环氧氯丙烷发生反应生成高聚物的结构简式为 ,
,
故答案为: .
.
点评 本题考查有机物分子式的确定,以及有机物官能团的结构和性质,题目难度中等,本题易错点为(3),注意结构简式的推断.

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测量等浓度的Na2CO3与C6H5ONa溶液的pH | Na2CO3溶液的pH大于C6H5ONa的pH | H2CO3的酸性大于C6H5OH |
| B | 将SO2通入溴水中 | 溴水褪色 | SO2具有漂白性 |
| C | 取少量的变质FeCl2晶体于试管中,逐滴加入酸性高锰酸钾溶液 | 酸性高锰酸钾溶液褪色 | FeCl2未完全变质 |
| D | 向苯酚的苯溶液中加入足量NaOH溶液,振荡静置 | 分层 | 上层为苯,下层为NaOH与苯酚钠的混合溶液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 配制FeCl3溶液时,可加入少量的稀硫酸以抑制Fe3+的水解 | |
| B. | MgCl2溶液中混有少量FeCl3杂质,可向混合溶液中加入MgO以除杂 | |
| C. | 氯化铝溶液蒸干灼烧得到的固体物质还是氯化铝 | |
| D. | 无色透明溶液中,Na+、Al3+、SO42-、Cl-、ClO-、I-能大量共存 |
| A. | 容量瓶、量筒和滴定管上都标有使用温度,量筒、容量瓶无“0”刻度,滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 | |
| C. | 向淀粉溶液中加入稀硫酸,加热几分钟后冷却,再加入新制的Cu(OH)2悬浊液,加热,没有砖红色沉淀生成,证明淀粉没有水解成葡萄糖 | |
| D. | 用干燥且洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH值 |
| A. | 标况下22.4L HF含有的分子数约为NA | |
| B. | 常温下,1L、pH=13的氨水中OH-的数目为0.1NA | |
| C. | 1mol铁与足量硫的完全反应,失去的电子数为3NA | |
| D. | 同温、同压、同体积的氢气和臭氧具有相同的分子数和原子数 |

| A. | 金属性:乙>丙>丁 | |
| B. | 原子半径大小:丁>丙>乙>己 | |
| C. | 甲、乙、丙的氧化物都含有共价键 | |
| D. | 丁和乙的原子核外电子数相差16,己和辛的原子核外电子数相差26 |
 一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )
一定条件下,在2L密闭容器中加入等物质的量的FeO和CO,发生下列反应FeO(s)+CO(g)═Fe(s)+CO2(g),在T1、T2温度下,物质的量n随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | 平衡前,随着反应的进行,容器内气体的相对分子质量始终不变 | |
| B. | 平衡时,其他条件不变,取出适当铁可提高CO的转化率 | |
| C. | 该反应的△H<0,K1<K2=1.5 | |
| D. | 当反应进行到t1时刻仅改变一个条件,可能是通入了氮气 |
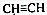 和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.
和CH3CHO(写结构简式)耗氧量相同,如氢原子数相同,等物质的量的CH4和CH3COOH、HCOOCH3、HOOCCH2COOH、HOOCCOOCH3耗氧量相同.