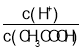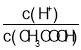题目内容
【题目】4种相邻的主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。回答下列问题:
m | n | ||
x | y |
(1)元素x在周期表中的位置是第____。其单质可采用电解熔融的___方法制备。用电子式表示该化合物的形成过程:___。
(2)m、n、y三种元素最高价氧化物的水化物中,酸性最强的是____,碱性最强的是____。(填化学式)
(3)气体分子(mn)2称为拟卤素,性质与卤素类似,其与氢氧化钠溶液反应的化学方程式是____。
【答案】第三周期第IIA族 氯化镁 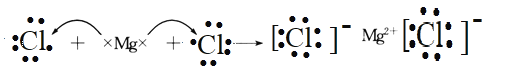 HNO3 Al(OH)3 2NaOH+(CN)2=NaCN+NaCNO+H2O
HNO3 Al(OH)3 2NaOH+(CN)2=NaCN+NaCNO+H2O
【解析】
这几种元素都是短周期元素,且为相邻主族,根据元素在周期表中的位置知,m和n位于第二周期,x和y位于第三周期,C原子核外电子数是m的2倍y的氧化物具有两性,则y是Al元素,根据元素位置知,是Mg元素、m是C元素、n元素N元素,根据元素的性质和位置解答本题。
(1)根据上述元素x是Mg元素,在周期表中的位置是第三周期第IIA族,金属性比较强,所以单质可以采用电解熔融氯化镁的方法制备;氯化镁属于离子化合物,该化合物的形成过程的电子式为: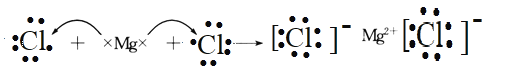 ;
;
答案:第三周期第IIA族;氯化镁;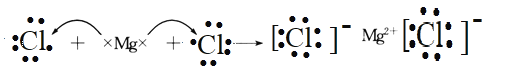
(2)m、n、y分别是C、N、Al,元素的金属性越强,其最高价氧化物的水化物碱性越强,元素的非金属性越强,其最高价氧化物的水化物酸性越强,这三种元素金属性最强的是Al元素,非金属性最强的是N元素,所以酸性最强的是HNO3,碱性最强的是Al(OH)3,故答案为:HNO3;Al(OH)3;
(3)气体分子(mn)2为(CN)2,根据氯气和氢氧化钠溶液反应可知 (CN)2和NaOH反应生成NaCN、NaCNO、H2O,其反应方程式为2NaOH+(CN)2=NaCN+NaCNO+H2O;
故答案为:2NaOH+(CN)2=NaCN+NaCNO+H2O。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案