题目内容
【题目】下列选项正确的是( )
A.25℃时,AgBr在0.0lmol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B.53℃时,将0.01mol/L的醋酸溶液加水不断稀释,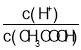 减小
减小
C.Na2CO3、NaHCO3溶液等浓度等体积混合后:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
【答案】D
【解析】
A、根据同离子效应,0.0lmol/L的MgBr2溶液中溴离子浓度大于0.0lmol/L的NaBr溶液中的溴离子浓度;B、加水稀释,促进醋酸电离;C、根据物料守恒,2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)];D、NaCN溶液和盐酸混合呈中性的溶液中根据电荷守恒以及物料守恒分析。
A、根据同离子效应,0.01mol/L的MgBr2溶液中溴离子浓度大于0.01mol/L的NaBr溶液中的溴离子浓度,故AgBr在0.01mol/L的MgBr2溶液中的溶解度小于0.01mol/LNaBr溶液中的溶解度,故A错误;
B、加水稀释,促进醋酸电离,故![]() 增大,故B错误;
增大,故B错误;
C、Na2CO3、NaHCO3溶液等浓度等体积混合后,根据物料守恒,2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)],故C错误;
D、NaCN溶液和盐酸混合呈中性的溶液中根据电荷守恒:c(Na+)+c(H+)=c(Cl-)+c(OH-)+c(CN-)以及物料守恒c(Na+)=c(CN-)+c(HCN)可知:c(Na+)>c(Cl-)=c(HCN),故D正确。
答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
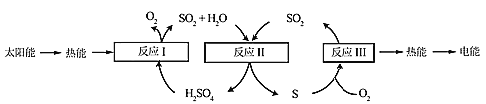
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示:
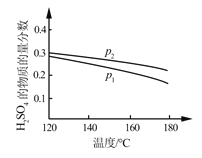
p2_______p 1(填“>”或“<”)。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+_________=_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到 2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。
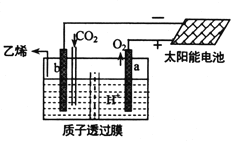
(5)据文献报道,二氧化碳可以在酸性水溶液中用惰性电极电解制得乙烯,其原理如图所示。则b电极上的电极反应式为__________________。
【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol·L-1HA溶液的pH=1 B. 该温度下Kw=1.0![]() 10-14
10-14
C. 微粒X表示OH-,Y表示H+ D. 混合溶液中:n(A-)+n(X)=n(Na+)
【题目】下列实验操作与实验目的对应的是 ( )
实验操作 | 实验目的 |
A、向淀粉水解液中直接滴加碘水 | 检验淀粉是否完全水解 |
B、C2H4 与SO2 混合气体通过盛有酸性高锰酸钾的洗气瓶 | 除去 C2H4 中的SO2 |
C、 将电石和饱和氯化钠溶液反应生成的气体通入饱和硫酸铜溶液中 | 验证生成的是乙炔气体 |
D、将溴乙烷与氢氧化钠水溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液 | 检验溴乙烷中的溴 |
A.AB.BC.CD.D