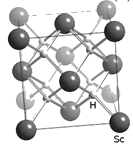
题目内容
【题目】H2C2O4为二元弱酸,25℃时,Ka1=5.4×10-2,Ka2=5.4×10-5。下列说法正确的是
A. 0.1mol/LNaHC2O4溶液中:c(H2C2O4)>c(C2O42-)
B. 反应HC2O4-+OH-![]() C2O42-+H2O的平衡常数K=5.4×1012
C2O42-+H2O的平衡常数K=5.4×1012
C. 0.1mol/LNa2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4)
D. pH=7的NaHC2O4与Na2C2O4的混合溶液中:c(Na+)=c(HC2O4-)+c(C2O42-)
【答案】C
【解析】
A.0.1mol/LNaHC2O4溶液中,HC2O4-存在水解平衡:HC2O4-+H2O![]() H2C2O4+OH-,水解平衡常数Kh=
H2C2O4+OH-,水解平衡常数Kh=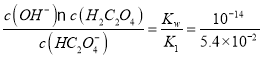 =1.8×10-13< Ka2,水解小于电离,所以NaHC2O4溶液显酸性,因此c(H2C2O4)<c(C2O42-),A错误;
=1.8×10-13< Ka2,水解小于电离,所以NaHC2O4溶液显酸性,因此c(H2C2O4)<c(C2O42-),A错误;
B.反应HC2O4-+OH-![]() C2O42-+H2O的电离平衡常数在25℃时K=5.4×10-5,B错误;
C2O42-+H2O的电离平衡常数在25℃时K=5.4×10-5,B错误;
C.Na2C2O4是强碱弱酸盐,其水溶液显碱性,根据质子守恒可得:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4),C正确;
D. pH=7的NaHC2O4与Na2C2O4的混合溶液中,根据电荷守恒可得:c(H+)+c(Na+)=c(HC2O4-)+2c(C2O42-)+c(OH-),由于c(H+)=c(OH-),所以c(Na+)=c(HC2O4-)+2c(C2O42-),D错误;
故合理选项是C。

【题目】有四种短周期元素,相关信息如下表。
元素 | 相关信息 |
A | 气态氢化物极易溶于水,可用作制冷剂 |
B | 单质的焰色反应为黄色 |
C | 单质是黄绿色气体,可用于自来水消毒 |
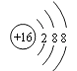
D | –2价阴离子的结构示意图是 |
请根据表中信息回答:
(1) A在周期表中的位置______。
(2) B与C形成化合物的类型为______(填“离子化合物”或“共价化合物”)
(3) 最高价氧化物对应的水化物的酸性C强于D,请用原子结构解释原因______。
(4) 已知硒(Se) 与D同主族,且位于D下一个周期,根据硒元素在元素周期表中的位置推测,硒可能具有的性质是______。
a.非金属性比D元素的强
b.SeO2既有氧化性又有还原性
c.最高价氧化物对应的水化物的化学式为H2SeO4