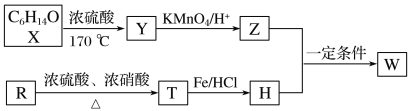
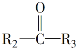
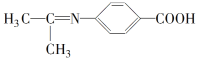
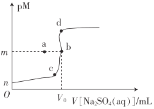
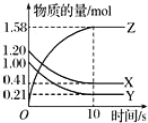
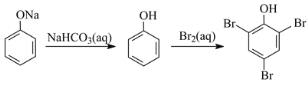
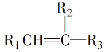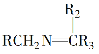题目内容
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。生产钕铁硼磁铁的主要原材料有稀土金属钕、高纯铁、铝、硼等。回答下列问题:
(1)钕(Nd)为60号元素,在周期表中位于第_________周期。基态硼原子中占据最高能级的电子,电子云轮廓图形状为_______。铁离子的电子排布式__________________
(2)实验测得AlCl3的实际存在形式为Al2Cl6,其分子的球棍模型如下图所示:
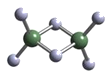
① 分子中A1原子采取____杂化。Al2Cl6属于____分子(填“极性”或“非极性”)。
②AlCl3与过量NaOH溶液反应生成Na[Al(OH)4],[A1(OH)4]-中存在的化学键有_________(填选项字母)。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)工业上可用电解熔融的FeO、Fe2O3冶炼高纯铁。基态Fe2+的价电子排布图(轨道表达式)为______________;用物质结构知识说明Fe2+容易被氧化成Fe3+的原因:________________________。
(4)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为_____。
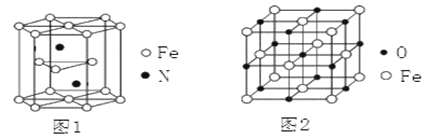
(5)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm—3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2—的最短核间距为_____________pm。
【答案】六或6 哑铃形或纺锤形 1s22s22p63s23p63d5 sp3 非极性 BC  Fe3+的3d轨道是半充满 3:1 12
Fe3+的3d轨道是半充满 3:1 12 
【解析】
(1)钕(Nd)为60号元素,在周期表中位于第六周期。基态硼原子中占据的最高能级为2p,电子云轮廓图形状为哑铃形或纺锤形。铁原子的电子排布式为1s22s22p63s23p63d64s2,形成离子优先失去最外层电子,故铁离子的电子排布式1s22s22p63s23p63d5;
(2)①Al2Cl6分子中每个铝原子与四个氯原子形成共价键,故A1原子采取sp3杂化。Al2Cl6分子中正负电荷中心重合,则Al2Cl6属于非极性分子;
②Al最外层的空轨可以接受氧原子提供的孤对电子形成配位键,O和H之间形成极性共价键,故选:BC;
(3)基态Fe2+的价电子排布式为3d6,则价电子排布图(轨道表达式)为 。Fe2+容易被氧化成Fe3+的原因是Fe3+的3d轨道是半充满,比较稳定;
。Fe2+容易被氧化成Fe3+的原因是Fe3+的3d轨道是半充满,比较稳定;
(4)氮化铁晶胞为六棱柱,顶点贡献率为![]() ,棱点贡献率为
,棱点贡献率为![]() ,面点贡献率为
,面点贡献率为![]() 。观察晶胞可知,12个铁原子位于顶点,2个点位于面心,3个铁位于体内。2个氮位于体内。则1个晶胞含铁微粒数为12
。观察晶胞可知,12个铁原子位于顶点,2个点位于面心,3个铁位于体内。2个氮位于体内。则1个晶胞含铁微粒数为12![]() +2
+2![]() +3=6,含氮微粒数为2,则该晶体中铁、氮的微粒个数之比为6:2=3:1;
+3=6,含氮微粒数为2,则该晶体中铁、氮的微粒个数之比为6:2=3:1;
(5)观察图2可知,上、中、下三层各4个氧离子(共12个氧离子)与中心的氧离子紧邻且等距离,而氧化亚铁晶体中氧离子、亚铁离子个数比为1:1,所以与Fe2+紧邻且等距离的Fe2+数目为12个。1个氧化亚铁晶胞含Fe2+数目为8![]() +6
+6![]() =4,含O2—数目为12
=4,含O2—数目为12![]() +1=4,所以,1个氧化亚铁晶胞含4个“FeO”,设Fe2+与O2—的最短核间距为d pm,有ρ=
+1=4,所以,1个氧化亚铁晶胞含4个“FeO”,设Fe2+与O2—的最短核间距为d pm,有ρ=![]() ,解得d=
,解得d=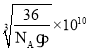 pm。
pm。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
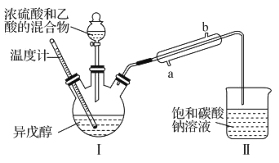
小学生10分钟应用题系列答案【题目】乙酸异戊酯是蜜蜂信息素的成分之一,具有香蕉的香味。实验室中可利用乙酸和异戊醇![]() 制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
制备乙酸异戊酯,装置图(夹持装置略)和所用药品有关数据如下。下列说法正确的是( )
药品 | 密度/( | 沸点/℃ | 水中溶解性 |
异戊醇 | 0.8123 | 131 | 微溶 |
乙酸 | 1.0492 | 118 | 易溶 |
乙酸异戊醇 | 0.8670 | 142 | 难溶 |
A.反应方程式为CH3COOH+![]()
![]()
![]()
B.实验时,冷凝水应从直形冷凝管的b口通入
C.异戊醇的同分异构体中属于醇类的有7种
D.反应后,取Ⅱ中物质经水洗、碱洗和蒸馏可提纯乙酸异戊酯