题目内容
12.最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇.“绿色自由”构想技术流程如下: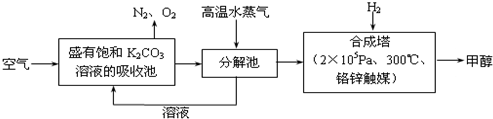
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947kJ的热量,试写出合成塔中发生反应的热化学方程式CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.47kJ•mol-1;下列措施中能使n(CH3OH)/n(CO2)增大的是CD.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2═2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-═O2↑+2H2O,则阴极反应为:2CO2+4e-+2H2O=2CO+4OH-.
(3)常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)>c(CO32-)
(填“>”、“=”或“<”),原因是因为既存在 HCO3-?CO32-+H+也存在HCO3-+H2O?H2CO3+OH-(用离子方程式和必要的文字说明).
(4)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9.应该选用的试剂是Ba(OH)2(或NaOH溶液和BaCl2溶液).
分析 (1)合成塔中发生反应为二氧化碳与氢气反应生成甲醇和水,根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量.书写热化学反应方程式时还应注意物质状态、反应热的正负号以及单位,结合化学移动原理分析选项判断比值的变化;
(2)阴极发生还原反应,CO2被还原生成CO,总反应式减去阳极反应式得阴极反应式;
(3)0.1mol•L-1NaHCO3 溶液的pH大于8,溶液显碱性,水解大于其电离;
(4)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全.
解答 解:(1)根据4.4 kg CO2与足量H2恰好完全反应,可放出4 947 kJ的热量,则1 mol CO2与氢气合成甲醇放出热量49.47 kJ的热量,所以热化学方程式为CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol,
对于反应CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol,措施中能使n(CH3OH)/n(CO2)增大的是
A.升高温度,平衡逆向进行,甲醇进行,二氧化碳增大,比值减小,故A不符;
B.充入He(g),使体系压强增大,分压不变平衡不变,比值不变,故B不符合;
C.将H2O(g)从体系中分离,平衡正向进行,甲醇增大,二氧化碳减小,比值增大,故C正确;
D.再充入1molCO2和3molH2 ,相当于增大压强,平衡正向进行,比值增大,故D正确;
故答案为:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-49.47kJ/mol;CD;
(2)总反应式为2CO2=2CO+O2,阳极反应为4OH--4e-=O2↑+2H2O,总反应式减去阳极反应式得阴极反应式,所以阴极反应为:2CO2+4e-+2H2O=2CO+4OH-,
故答案为:2CO2+4e-+2H2O=2CO+4OH-;
(3)0.1mol•L-1NaHCO3 溶液的pH大于8,溶液显碱性,水解大于其电离,则c(HCO3-)>c(CO3 2-),
故答案为:>;因为既存在 HCO3-?CO32-+H+也存在HCO3-+H2O?H2CO3+OH-,而HCO3-的水解程度大于电离程度;
(4)根据CaCO3、BaCO3的溶度积大小可知BaCO3更难溶,因此令CO2生成BaCO3反应更完全,故可选择Ba(OH)2(或NaOH溶液和BaCl2溶液)作为CO2的沉淀剂,测定的数据除空气的体积外,还需要测定实验时的温度、压强、沉淀的质量,故答案为:Ba(OH)2(或NaOH溶液和BaCl2溶液).
点评 本题以对CO2创新利用的研究为载体,考查热化学方程式、沉淀剂选择等知识,难度中等,旨在考查学生对知识的掌握及迁移运用能力.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案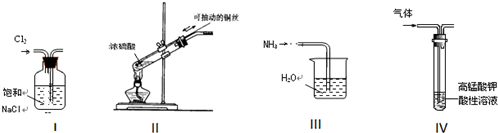
| A. | 实验Ⅰ:除去Cl2中的HCl | B. | 实验Ⅱ:使反应符合绿色化要求 | ||
| C. | 实验Ⅲ:吸收NH3 | D. | 实验Ⅳ:除去CO2中混有的SO2 |
| A | B | C |
| ①属于烃类,相对分子质量为84 ②完全燃烧的产物中 n(CO2):n(H2O)=1:1 ③不能使溴的四氯化碳溶液褪色 ④一氯代物只有两种结构 | ①0.2mol B完全燃烧,只生成35.2g CO2和18g H2O ②经测定,0.1mol B的质量为7.4g ③在浓硫酸,加热条件下,可到两种能使溴水褪色的有机产物(不考虑顺反异构) | 2属于烃的含氧衍生物 ②分子比例模型为:  |
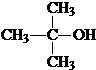
(1)A的结构简式为
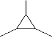 (或
(或 );
);(2)B的分子式是C4H10O;B在加热,Cu存在下与O2反应的化学方程式为:
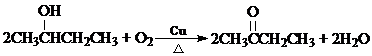 ;其反应类型为:氧化反应.
;其反应类型为:氧化反应.(3)X为B的同类别的同分异构体,且X分子中有2种不同位置的氢原子.X在浓硫酸,加热条件下,可生成Y,Y能使溴水褪色.写出生成Y的化学方程式:
 +H2O;
+H2O;(4)C在一定条件下,反应可以得到一种新型的高分子生物降解材料(PLA),写出生成PLA的化学方程式:n
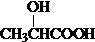
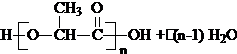 .
. | A. | NH4HCO3 | B. | NH4HSO4 | C. | NH4Cl | D. | NH3•H2O |
| A. | [Cr(H2O)6]Cl3 | B. | [Cr(H2O)4Cl2]Cl•2H2O | ||
| C. | [Cr(H2O)5Cl]Cl2•H2O | D. | [Cr(H2O)3Cl3]•3H2O |
| A. | 白酒、食醋、汽油都是混合物 | |
| B. | 乙烯是一种植物生长调节剂,可用于催熟水果 | |
| C. | 煤经干馏、气化和液化等物理变化过程,可变为清洁能源 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |
 请完成下列各题:
请完成下列各题: