题目内容
3.将60g乙酸和92g乙醇混合,在浓硫酸存在的条件下充分反应,如果实际产率是理论产率的70%,则生成有机物的质量是多少?分析 60g乙酸的物质的量为:$\frac{60g}{60g/mol}$═1mol,92g乙醇的物质的量为:$\frac{92g}{46g/mol}$═1mol,根据方程式:CH3COOH+HOCH2CH3$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,乙醇过量,应按乙酸完全反应来计算,由此分析解答.
解答 解:60g乙酸的物质的量为:$\frac{60g}{60g/mol}$═1mol,92g乙醇的物质的量为:$\frac{92g}{46g/mol}$═1mol,所以乙醇过量,
CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
60 46 88
60g m(CH3COOC2H5)
解得:m(CH3COOC2H5)=88g
88g×70%=61.6g
答:反应中得到乙酸乙酯61.6g.
点评 本题考查乙酸乙酯的制备、有关化学方程式的简单计算,题目难度中等,过量判断是化学方程式的计算是易错点.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
13.(1)为进行Ⅰ项中的除杂实验(括号内为杂质),请从Ⅱ项中选出一种试剂,从Ⅲ项中选出一合适的实验操作方法分离,将标号填在后面的答案栏内.
(2)如图均是由4个碳原子结合成的6种有机物(氢原子没有画出).

①有机物(a)有一种同分异构体,试写出其结构简式CH3CH2CH2CH3.
②上述有机物中与(c)互为同分异构体的是(b)(f)(填代号).
③任写一种与(e)互为同系物的有机物的结构简式CH≡CH.
④(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有(b)(c)(e)(填代号).
(3)下列实验中,需要用水浴加热的是②⑥,
①新制Cu(OH)2与乙醛反应; ②银镜反应; ③溴乙烷的水解;
④乙酸和乙醇反应制乙酸乙酯;⑤由乙醇制乙烯;⑥苯的硝化.
| Ⅰ除杂实验 | Ⅱ试剂 | Ⅲ操作方法 | 答案 | ||
| Ⅰ | Ⅱ | Ⅲ | |||
| ①苯(苯酚) | A.饱和Na2CO3溶液 B.NaCl晶体 C.NaOH溶液 D.CaO | a.蒸馏 b.分液 c.盐析、过滤 d.萃取 | ① | ||
| ②乙醇(水) | ② | ||||
| ③肥皂(甘油、水) | ③ | ||||
| ④乙酸乙酯(乙酸) | ④ | ||||

①有机物(a)有一种同分异构体,试写出其结构简式CH3CH2CH2CH3.
②上述有机物中与(c)互为同分异构体的是(b)(f)(填代号).
③任写一种与(e)互为同系物的有机物的结构简式CH≡CH.
④(a)(b)(c)(d)(e)五种物质中,4个碳原子一定处于同一平面的有(b)(c)(e)(填代号).
(3)下列实验中,需要用水浴加热的是②⑥,
①新制Cu(OH)2与乙醛反应; ②银镜反应; ③溴乙烷的水解;
④乙酸和乙醇反应制乙酸乙酯;⑤由乙醇制乙烯;⑥苯的硝化.
11.关于苯的叙述正确的是( )
| A. | 苯的密度大于水 | |
| B. | 苯中含有碳碳双键,所以苯属于烯烃 | |
| C. | 苯分子中6个碳碳键完全相同 | |
| D. | 苯可以与溴水、高锰酸钾溶液反应而使它们褪色 |
18.下列叙述正确的是( )
| A. | 棉花和蚕丝的主要成分都是纤维素 | |
| B. | 植物油属于油脂,它是一种高分子化合物 | |
| C. | 蔗糖在稀硫酸的催化下,最终全部水解为葡萄糖 | |
| D. | 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了有香味的酯 |
8.下列说法中正确的是( )
| A. | 甲苯、二甲苯都属于苯的同系物,依据是这两种物质分子中均含有甲基 | |
| B. | 醇类的官能团是跟烃分子中饱和碳原子直接相连的羟基 | |
| C. | 醇类和酚类具有相同的官能团,因而具有相同的化学性质 | |
| D. | 甲醇、乙二醇、甘油都属于醇,依据是这三种物质分子中均含有饱和烃基 |
15.实验室将化学式为C8H16O2的酯水解,得到A和B两种物质,A氧化可转变为B,符合上述性质的酯的结构种类有( )
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
 短周期元素Q、R、T、P、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、P、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: ,用化学方程式表示工业上冶炼该单质的反应原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑.
,用化学方程式表示工业上冶炼该单质的反应原理2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑. ,实验室检验该氢化物的方法是ks5u用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生.
,实验室检验该氢化物的方法是ks5u用镊子夹住湿润的红色石蕊试纸靠近气体,观察到试纸变蓝或用蘸有浓盐酸的玻璃棒靠近气体,观察到有白烟产生.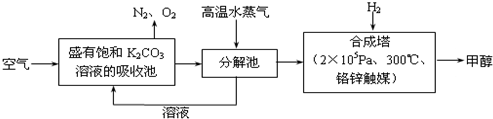
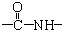 、一个
、一个 、一个
、一个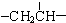 ,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为:
,还有一个显碱性、一个显酸性的官能团.将该物质在一定条件下水解,能得到两种α-取代羧酸.其中一种的结构简式为: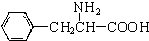 ,另一种水解产物结构简式为:CH3CH(NH2)COOH;
,另一种水解产物结构简式为:CH3CH(NH2)COOH;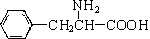 与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(
与CH3OH在一定条件下生成的酯是一种有用的合成中间体,利用该酯可与一种醇X发生取代反应,生成一种新的酯(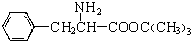 )和CH3OH,则醇X的结构简式为(CH3)3COH.
)和CH3OH,则醇X的结构简式为(CH3)3COH.