题目内容
14.HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+.AgNO2是一种难溶于水、易溶于酸的化合物.试回答下列问题:(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒.下列叙述不正确的是D(填字母编号).
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)下列方法中,不能用来区分NaNO2和NaCl的是B(填字母编号).
A.测定这两种溶液的pH B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI-淀粉溶液来区别 D.用AgNO3和HNO3两种试剂来区别
(3)单质铁与过量稀硫酸反应可以制取FeSO4.若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求不引入新的杂质,可选用的最佳试剂是c(填字母编号).
a.Cl2 b.Fe c.H2O2 d.HNO3
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出该反应的离子方程式:NO2-+Cl2+H2O═NO3-+2H++2 Cl-.
分析 (1)由题给信息可知Fe2+转化为Fe3+而中毒,服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性;
B.甲基橙的变色范围是3.1-4.4;
C.酸性条件下,亚硝酸根离子能被碘离子还原生成一氧化氮,同时生成碘单质;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成白色沉淀;
(3)Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质;
(4)把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,二者发生氧化还原反应.
解答 解:(1)服用维生素C可以解毒,说明在维生素C作用下Fe3+又转化为Fe2+,Fe元素化合价降低,被氧化,则维生素具有还原性,而亚硝酸盐,会导致Fe2+转化为Fe3+,说明亚硝酸盐具有氧化性,在反应中为氧化剂,所以维生素C是还原剂,
故答案为:D;
(2)A.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,相同物质的量浓度的两种溶液的pH不同,所以可以用测定这两种溶液的pH值鉴别,故A不选;
B.亚硝酸钠是强碱弱酸盐其水溶液呈碱性,氯化钠是强酸强碱盐其水溶液呈中性,甲基橙的变色范围是3.1-4.4,所以亚硝酸钠和氯化钠溶液加入甲基橙后溶液都呈黄色,反应现象相同,所以不能用甲基橙鉴别,故B选;
C.在酸性条件下,亚硝酸钠和碘离子反应方程式为2NO2-+2I-+4H+=2NO↑+I2+2H2O,碘遇淀粉变蓝色,氯离子和碘离子不反应,所以反应现象不同,所以可以用酸性条件下的KI淀粉试液来区别,故C不选;
D.亚硝酸根离子不和银离子反应,氯离子和银离子反应生成不溶于硝酸的白色沉淀,反应现象不同,所以可以用AgNO3和HNO3两种试剂来区别,故D不选;
故答案为:B;
(3)ad都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确额的答案选c;
故答案为:c;
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,反应的离子方程式为:NO2-+Cl2+H2O=NO3-+2H++2Cl-,
故答案为:NO2-+Cl2+H2O=NO3-+2H++2Cl-.
点评 本题考查了二价铁离子与三价铁离子的转化、氧化还原方程式书写,侧重于学生的分析能力的考查,明确氧化还原反应规律是解题关键,题目难度中等.

| A. | 蒸发掉1克水,有少量固体析出 | B. | 降低温度,有少量固体析出 | ||
| C. | 加入少量硝酸钾固体,固体不溶解 | D. | 加入少量水,没有固体析出 |
| A. | 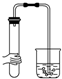 | B. |  | C. | 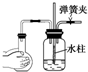 | D. | 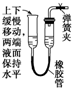 |
| A. | 水和双氧水--加二氧化锰 | |
| B. | 二氧化碳和氮气--将燃着的木条伸入瓶中 | |
| C. | 高锰酸钾和二氧化锰--看颜色 | |
| D. | 石灰水和水--通二氧化碳 |
| A. | 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.2NA | |
| B. | 1L0.1mol•L-1的H2SO3溶液中含有H+的数目为0.2NA | |
| C. | 7.8gNa2O2中含有的阴离子数目为0.1NA | |
| D. | 常温常压下,14g乙烯和丙烯的混合气体中氢原子数为2NA |
| A. | 氢氧化铝和碳酸氢钠都可以作为治疗胃酸过多的药剂 | |
| B. | 血液透析是利用了胶体的性质 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 碘是人体必需微量元素,所以要多吃富含碘单质的食物 |
| A. | 氢氧化铝:麻醉剂 | B. | 阿司匹林:消炎抗菌 | ||
| C. | 麻黄碱:止咳平喘 | D. | 青霉素:解热镇痛 |
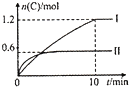 在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )
在2L的恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)+D(s)△H=-akJ.mol-1,实验内容和结果分别如下表和如图所示.下列说法正确的是( )| 实验 | 温度 | 起始物质的量 | 热量 | |
| 序号 | A | B | 变化 | |
| I | 600℃ | 1mol | 3mol | 96 kJ |
| n | 800℃ | 0.5mol | 1.5mol | ---- |
| A. | 实验I中,10min内平均速率v(B)=0.06mol.L-1•min-1 | |
| B. | 上述方程式中a=160 | |
| C. | 600℃时,该反应的平衡常数是0.45 | |
| D. | 向实验E的平衡体系中再充入0.5molA和1.5molB,A的转化率不变 |