题目内容
室温下,下列各组离子能大量共存的是
| A.稀硫酸中:K+、Mg2+、AlO2-、S2O32- |
| B.Na2S溶液中:SO42-、K+、Cl-、Cu2+ |
C.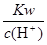 =10-13mol·L-1溶液中:Fe3+、NH4+、Mg2+、 SO42- =10-13mol·L-1溶液中:Fe3+、NH4+、Mg2+、 SO42- |
| D.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3- |
C
解析试题分析:A、Mg2+、AlO2-、S2O32-能与H+反应,不能大量共存,错误;B、S2?能与Cu2+反应生成CuS沉淀,不能大量共存,错误;C、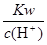 =10-13mol·L-1溶液呈酸性,各离子互不反应,可以大量共存,正确;D、CO2、H2O能与ClO?反应,不能大量共存,错误。
=10-13mol·L-1溶液呈酸性,各离子互不反应,可以大量共存,正确;D、CO2、H2O能与ClO?反应,不能大量共存,错误。
考点:本题考查离子共存。

练习册系列答案
相关题目
下列对各组离子或物质是否能够大量共存解释正确的是 ( )
| A | 常温常压下NH3、O2、H2、CO2 | 不能共存 | NH3为碱性气体,CO2为酸性气体,二者反应生成(NH4)2CO3 |
| B | c(OH-)=1×10-13mol/L溶液中,Fe2+、NO3-、SO42-、Na+ | 不能共存 | 发生反应Fe2++NO3-+4H+=3Fe3++NO+2H2O |
| C | 溶液中: K+、Cu2+、Cl-、NH3?H2O | 不能共存 | 发生反应Cu2++2OH-=Cu(OH)2 |
| D | 溶液中Al3+、Na+、SO42-、HCO3- | 可以共存 | 不能发生反应 |
下列有关叙述中正确的是
| A.难溶于水的电解质一定是弱电解质 |
| B.强电解质在水溶液中的电离过程是不可逆的 |
| C.易溶于水的电解质一定是强电解质 |
| D.强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 |
某混合溶液中可能含有下列离子中的若干种:NH4+、Na+、Al3+、Fe2+、Fe3+、AlO2-、SO42-、I-、NO3-、CO32-,已知各离子的浓度均约为0.1mol/L,现取两份20mL该溶液进行如下实验:
(1)第一份加入足量盐酸,产生气体在空气中变为红色,在反应后的溶液中加入BaCl2溶液,有白色沉淀产生。
(2)第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,并有气体逸出。
根据上述实验情况,以下说法错误的是( )。
| A.该混合溶液中一定不含有Fe3+、AlO2-、Al3+、CO32- |
| B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I- |
| C.该混合溶液中肯定含有Fe2+、NH4+、SO42-、NO3- |
| D.向该混合溶液中滴加酚酞试液后呈红色 |
在加入铝粉能放出氢气的溶液中,下列各组离子可能大量共存的是 ( )
A.NH NO NO CO CO Na+ Na+ | B.Na+ Ba2+ Mg2+ HCO |
C.NO K+ AlO K+ AlO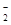 OH- OH- | D.NO Mg2+ K+ Cl- Mg2+ K+ Cl- |
离子方程式H+ + OH-= H2O可表示的化学方程式是( )
| A.盐酸与氢氧化铜的反应 | B.硫酸氢钠与氢氧化钠的反应 |
| C.硫酸与氢氧化镁的反应 | D.盐酸与氨水的反应 |
下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是
| A.NH4+、K+、Cl-、OH- | B.H+、Fe2+、MnO4-、Cl- |
| C.Ba2+、Na+、NO3-、SO42- | D.Na+、H+、CO32-、SO42- |
常温下,下列各组离子在指定溶液中可能大量共存的是:
| A.滴入甲基橙显红色的溶液中: Na+、NO3ˉ、 Fe2+、SO32ˉ |
| B.水电离出的 c ( H+) = 10ˉ12 mol/L 的溶液中:K+、 AlO2ˉ、 CH3COOˉ、 Clˉ |
C. =10ˉ12的溶液中: K+、ClOˉ、S2ˉ、 Clˉ =10ˉ12的溶液中: K+、ClOˉ、S2ˉ、 Clˉ |
| D.c ( Fe 3+ ) =" 0" .1 mol/L 的溶液中: K+、Clˉ 、SO42ˉ、 SCNˉ |
