题目内容
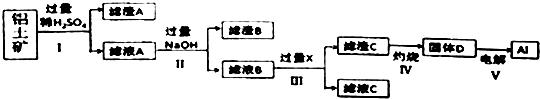
【题目】现有短周期元素X形成的单质A与NaOH溶液反应,有如下转化关系 ![]() ,(若产物中有水生成则省略未表示出来).
,(若产物中有水生成则省略未表示出来).
(1)若常温常压下,A为气态,且B、C中均有X元素,则A与NaOH溶液反应的离子方程式为;
(2)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则工业制取A化学方程式为;
(3)若A为金属,C为气体,则A 与NaOH溶液反应的离子方程式为
(4)由(2)和(3)中两种单质形成合金在工业、建筑业中有重要的用途.一个探究性学习小组,他们拟用该合金与足量稀硫酸的反应测定通常状况下气体摩尔体积,实验装置如下: 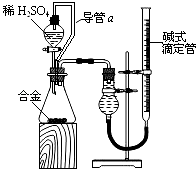
①装置中导管a的作用是平衡分液漏斗上下管口的压强,有利于液体滴下和;
②实验中准确测得4个数据:实验前该合金的质量m1g,实验后残留固体的质量m2g,实验前后碱式滴定管中液面读数分别为V1mL、V2mL;则通常状况时气体摩尔体积Vm=LmoL﹣1 .
【答案】
(1)Cl2+2OH﹣=Cl﹣+ClO﹣+H2O
(2)2C+SiO2 ![]() 2CO↑+Si
2CO↑+Si
(3)2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑
(4)使测得的气体体积较准确,减少实验误差;![]()
【解析】解:(1)若常温常压下,A为气态,且B、C中均有X元素,A为氯气,与NaOH溶液反应生成氯化钠、次氯酸钠与水,反应离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,
所以答案是:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
(2.)若常温常压下,A为非金属固态单质,且其在电子工业中有着重要的用途,则A为Si,工业上用碳与二氧化硅高温下反应制备Si,同时生成CO,反应方程式为:2C+SiO2 ![]() 2CO↑+Si,
2CO↑+Si,
所以答案是:2C+SiO2 ![]() 2CO↑+Si;
2CO↑+Si;
(3.)若A为金属,C为气体,则A为Al,B为偏铝酸钠,C为氢气,反应离子方程式为:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑,
所以答案是:2Al+2OH﹣+2H2O=2AlO2﹣+3H2↑;
(4.)①通过测量Al及硫酸与Al反应生成氢气的体积计算摩尔质量,可以消除加入硫酸排出气体的体积,使测得的气体体积较准确,减少实验误差,
所以答案是:使测得的气体体积较准确,减少实验误差;
②Al的质量为(m1﹣m2)g,生成氢气的体积为(V1﹣V2)×10﹣3L,由电子转移守恒: ![]() ×2=
×2= ![]() ×3,整理可得Vm=
×3,整理可得Vm= ![]() LmoL﹣1 ,
LmoL﹣1 ,
所以答案是: ![]() .
.