题目内容
【题目】研究小组采用电解法(惰性电极)将含有Al(OH)3、MnO2和少量Na2CrO4的浆液分离成固体混合物和含铬元素的溶液,装置如图。下列说法不正确的是( )
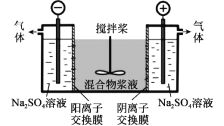
A.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
B.适当增大电压,CrO![]() 也可在阴极室转化为Cr(OH)3除去
也可在阴极室转化为Cr(OH)3除去
C.阴极室生成的物质可用于固体混合物Al(OH)3和MnO2的分离
D.CrO![]() 通过阴离子交换膜进入阳极室,从而实现与浆液的分离
通过阴离子交换膜进入阳极室,从而实现与浆液的分离
【答案】B
【解析】
电解时,CrO42通过阴离子交换膜向阳极移动,在阳极氢氧根离子失电子发生氧化反应,OH放电后,阳极池酸度增强,发生反应2CrO42+2H+=Cr2O72+H2O,阴极发生还原反应生成氢气和NaOH,以此解答该题。
A.阳极发生氧化反应,该电极的电极反应式为:2H2O - 4e-= O2↑+4H+,故A正确;
B.适当增大电压,电解时,右池为阳极,阴离子向阳极移动,CrO42通过阴离子交换膜向阳极移动,从而CrO42-能从浆液中分离出,故B错误;
C.阴极发生还原反应生成氢气,同时还会得到硫酸钠、氢氧化钠,Al(OH)3和MnO2中的氢氧化铝可以溶于氢氧化钠,氢氧化钠可用于固体混合物Al(OH)3和MnO2的分离,故C正确;
D.电解时,CrO42-通过阴离子交换膜向阳极移动,通电后CrO42-将通过阴离子膜进入阳极室,从而实现与浆液的分离,故D正确;
答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】甲醇既是重要的化工原料,又可作为燃料,利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2
CH3OH(g)+H2O(g) ΔH2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)回答下列问题:已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C≡O | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1 076 | 465 | 413 |
由此计算ΔH1=______kJ·mol-1;已知ΔH2=-58 kJ·mol-1,则ΔH3=_______kJ·mol-1。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1 275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式_________________。
(3)已知常温时红磷比白磷稳定,已知:
①P4(白磷,s)+5O2(g)===2P2O5(s)ΔH1
②4P(红磷,s)+5O2(g)===2P2O5(s)ΔH2
比较反应中ΔH的大小:ΔH1_______ΔH2(填“>”、“<”或“=”)。
(4)已知:稀溶液中,H+(aq)+OH﹣(aq)===H2O(l)ΔH=﹣57.3 kJ![]() ,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。
,则浓硫酸与稀氢氧化钠溶液反应生成1 mol水,放出的热量_____57.3 kJ(填“>”、“<”或“=”)。