题目内容
6.下列对氯气的叙述正确的是( )| A. | 氯气可使湿润的红色布条褪色,所以氯气具有漂白性 | |
| B. | 过量的铁在氯气中燃烧可生成氯化亚铁 | |
| C. | 氯气没有漂白性,但通入品红溶液中,品红褪色 | |
| D. | 闻其气味时要小心的将集气瓶放在鼻孔下直接闻 |
分析 A..氯气可使湿润的红色布条褪色,是由于氯气与水反应生成了次氯酸,次氯酸具有漂白性;
B.铁与氯气反应生成高价铁;
C.氯气与水反应生成的次氯酸具有漂泊性;
D.闻氯气时,不能直接放在鼻子下闻.
解答 解:A.氯气与水反应生成了次氯酸,次氯酸具有漂白性,所以氯气可使湿润的红色布条褪色,氯气无漂白性,故A错误;
B.过量的铁在氯气中燃烧可生成氯化铁,故B错误;
C.氯气没有漂白性,但通入品红溶液中,氯气与水反应生成的次氯酸具有漂白性,能够使品红褪色,故C正确;
D.闻氯气时,不能直接放在鼻子下闻,应用手在集气瓶口轻轻扇动来闻气体的气味,故D错误;
故选:C.
点评 本题考查了氯气的性质,熟悉氯气的化学性质是解题关键,注意氯气不具有漂白性,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.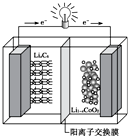 某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )
某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )
 某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )
某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )| A. | 放电时LixC6发生氧化反应 | |
| B. | 充电时将电池的负极与外接电源的负极相连 | |
| C. | 充电时,Li+通过阳离子交换膜从左向右移动 | |
| D. | 放电时,电池的正极反应为Li1-xCoO2+xLi++xe-═LiCoO2 |
17.下列过程吸收热量的是( )
| A. | 硝酸铵和适量的水混合 | B. | 氧化钙和适量的水混合 | ||
| C. | 稀盐酸与金属镁反应 | D. | 汽油在空气中燃烧 |
14.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
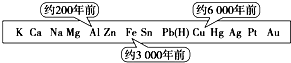

| A. | 金属的导电性强弱 | B. | 金属在地壳中的含量多少 | ||
| C. | 金属的活动性大小 | D. | 金属的化合价高低 |
1.某有机物的结构如图所示: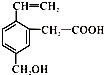 ,这种有机物可能具有的性质是①能发生加成反应、②能使酸性KMnO4溶液褪色、③能跟NaOH溶液反应、④能发生酯化反应、⑤能发生加聚反应( )
,这种有机物可能具有的性质是①能发生加成反应、②能使酸性KMnO4溶液褪色、③能跟NaOH溶液反应、④能发生酯化反应、⑤能发生加聚反应( )
 ,这种有机物可能具有的性质是①能发生加成反应、②能使酸性KMnO4溶液褪色、③能跟NaOH溶液反应、④能发生酯化反应、⑤能发生加聚反应( )
,这种有机物可能具有的性质是①能发生加成反应、②能使酸性KMnO4溶液褪色、③能跟NaOH溶液反应、④能发生酯化反应、⑤能发生加聚反应( )| A. | 只有②③④ | B. | 只有①②③ | C. | 全部 | D. | 只有②④⑤ |
11.下列有关钠和镁的说法中,正确的是( )
| A. | 电解NaCl溶液可以得到金属钠 | |
| B. | 金属钠在Cl2中燃烧产生黄色火焰得到黄色固体 | |
| C. | 金属镁着火,可用二氧化碳灭火 | |
| D. | 金属镁燃烧时发出耀眼的白光,因此常用来制造信号弹和焰火 |
15.将a g 含NaOH样品溶解在b mL 0.1mol/L的硫酸中(杂质不反应),再加入c mL 0.1mol/L的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是( )
| A. | $\frac{b-c}{125a}$×100% | B. | $\frac{b-2c}{125a}$×100% | C. | $\frac{b-c}{250a}$×100% | D. | $\frac{8b-8c}{a}$×100% |
1.下列有关化学键的叙述中,正确的是( )
| A. | 离子化合物中只含离子键 | |
| B. | 单质分子中不存在化学键 | |
| C. | 氧化物中一定含有化学键 | |
| D. | 含有共价键的化合物一定是共价化合物 |