题目内容
(11分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题:
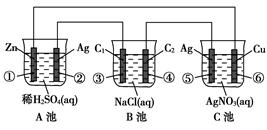
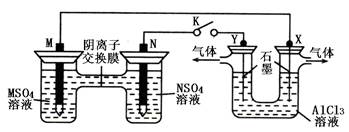
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。

(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
(1)原电池 电解池 电镀池 (2)Zn-2e-==Zn2+ 2Cl--2e-==Cl2↑ Ag-e-==Ag+
(3)65 216 (4)C池
(3)65 216 (4)C池
试题分析:由于两个电极活动性的差异最大的是Zn与Ag,所以A池是原电池。Zn是负极,发生氧化反应,Ag为正极,在正极上发生还原反应。相对其它池来说是电源。B池是电解池;C池是电解池。由于Ag电极与电源的正极连接,是阳极,Cu是与电源的负极连接的,是阴极。因此该池也就是电镀池。(2)①在Zn电极上发生反应: Zn-2e-==Zn2+;在③电极上Cl-放电,电极反应式是2Cl--2e-= Cl2↑;在⑤上由于Ag作阳极,所以是单质Ag失去电子,电极反应式是Ag-e-==Ag+。(3)当电路上有2 mol电子流过时,因为Zn是+2价的金属,所以有1mol的Zn发生氧化反应,所以①极上质量会减轻65g。在⑥极上会有质量变化2mol的Ag+得到电子,被还原,析出金属Ag,其质量为2mol×108g/mol=216g。(4)反应进行一段时间后,A池的电解质溶液会逐渐有H2SO4变为Zn SO4;B池会逐渐变为NaOH溶液;而在C池因为阳极产生Ag+离子,在阴极上是Ag+得到电子,被还原,所以仍然是AgNO3溶液, 浓度基本不变。选项为C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
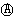 为电流表)。请回答:
为电流表)。请回答:
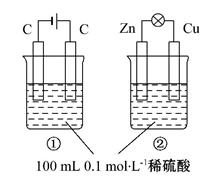

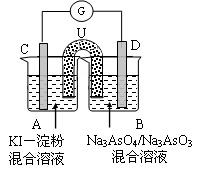

 AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为  Fe(OH)3(s)+3HCl(aq);△H >0
Fe(OH)3(s)+3HCl(aq);△H >0