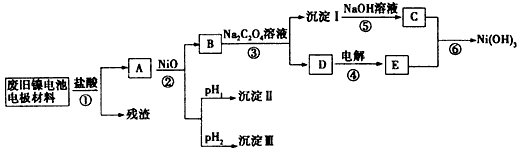
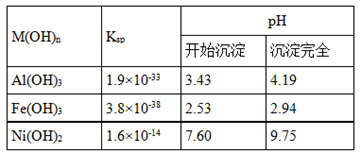
题目内容
(12分)(1)右图为阳离子交换膜法电解饱和食盐水(滴有酚酞)原理示意图,E口产生H2,电解食盐水的离子方程式为: ,溶液变红色的是: 区(填A或B)。
(2)电化腐蚀是钢铁发生腐蚀的主要原因,又可分为吸氧腐蚀和析氢腐蚀,发生吸氧腐蚀的电极反应式:负极 正极
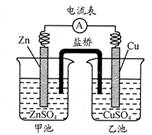
(3)下图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计
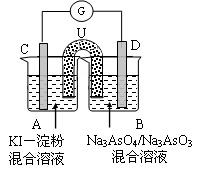

此装置中进行的反应是可逆反应,其反应方程式式为:AsO43-+2I-+H+ AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
(2)电化腐蚀是钢铁发生腐蚀的主要原因,又可分为吸氧腐蚀和析氢腐蚀,发生吸氧腐蚀的电极反应式:负极 正极
(3)下图是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,G是灵敏电流计


此装置中进行的反应是可逆反应,其反应方程式式为:AsO43-+2I-+H+
 AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为
AsO33-+I2+H2O,向B杯中加入适量较浓的硫酸,发现G的指针向右偏移。此时A杯中的主要实验现象是 D电极上的电极反应式为 ⑴2Cl-+2H2O Cl2↑+H2↑+2OH-;溶液变红色的是 B区;
Cl2↑+H2↑+2OH-;溶液变红色的是 B区;
⑵吸氧腐蚀的电极反应式:负极 Fe- 2e-=Fe2+ 正极 O2+4e-+2H2O=4OH-
⑶实验现象是 溶液由无色变蓝色 电极反应式为 AsO43-+2e-+2H+=AsO33-+H2O
 Cl2↑+H2↑+2OH-;溶液变红色的是 B区;
Cl2↑+H2↑+2OH-;溶液变红色的是 B区;⑵吸氧腐蚀的电极反应式:负极 Fe- 2e-=Fe2+ 正极 O2+4e-+2H2O=4OH-
⑶实验现象是 溶液由无色变蓝色 电极反应式为 AsO43-+2e-+2H+=AsO33-+H2O
试题分析:(1)电解时在溶液中阳离子Na+、H+的放电能力H+ >Na+,所以在阴极发生反应:2H++2e-= H2↑,随着H+的不断放电,破坏了附近的水的电离平衡,最终使附近的水溶液显碱性,所以滴加酚酞溶液变为红色。即B区溶液变为红色;由于阴离子的沸点能力:Cl->OH-,在阳极Cl-放电产生氯气2Cl—2e-= Cl2↑,电解的总方程式为:2Cl-+2H2O
 Cl2↑+H2↑+2OH-。(2)钢铁发生吸氧腐蚀时Fe作负极,杂质C作正极。负极的电极反应式Fe- 2e-=Fe2+;正极的电极反应使是O2+4e-+2H2O=4OH-。(3)根据盐桥的示意图可知:在A杯中I-失去电子变为I2,I2遇淀粉变为蓝色。因此A烧杯的主要实验现象是溶液由无色变蓝色;在D电极上发生的电极反应为AsO43-+2e-+2H+=AsO33-+H2O。因此C为负极,D为正极。
Cl2↑+H2↑+2OH-。(2)钢铁发生吸氧腐蚀时Fe作负极,杂质C作正极。负极的电极反应式Fe- 2e-=Fe2+;正极的电极反应使是O2+4e-+2H2O=4OH-。(3)根据盐桥的示意图可知:在A杯中I-失去电子变为I2,I2遇淀粉变为蓝色。因此A烧杯的主要实验现象是溶液由无色变蓝色;在D电极上发生的电极反应为AsO43-+2e-+2H+=AsO33-+H2O。因此C为负极,D为正极。
练习册系列答案
 一线名师权威作业本系列答案
一线名师权威作业本系列答案
相关题目
 C+LiCoO2锂硫电池的总反应为:2Li+S
C+LiCoO2锂硫电池的总反应为:2Li+S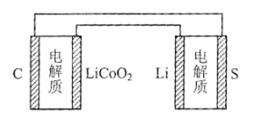


 2CO2+4H2O
2CO2+4H2O