题目内容
【题目】工业上可采用丙烯氨氧化法制丙烯脂,回答下列问题:
I.丙烯的制备反应方程式为C3H8(g)=C3H6(g)+H2(g)。
已知:部分共价键的键能如下:

(1)制备丙烯反应的△H=__。该反应在__(“高温”或“低温”)下有利于自发进行。
(2)提高丙烯产率可以选择__(填序号)。
A.升温 B.减小压强 C.充入H2(恒容) D.加入催化剂
(3)已知:CO2(g)+H2(g)=CO(g)+H2O(g) H=-41kJ·mol-1,工业上选择向反应体系中加入CO2,提高丙烷的转化率,从化学平衡原理角度说明原因:__。
II.利用丙烯制备丙烯腈,反应方程式如下:2C3H6(g)+2NH3(g)+3O2(g)![]() 2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
2CH2=CHCN(g)+6H2O(l) H=-1294kJ·mol-1。
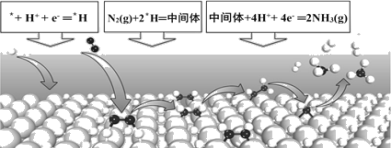
(4)主要的反应机理如下:
CH3-CH=CH2→[CH2![]() CH
CH![]() CH2]+H 慢 H>0
CH2]+H 慢 H>0
[CH2![]() CH
CH![]() CH2]+[NH]→CH2=CH-CN+3H 快
CH2]+[NH]→CH2=CH-CN+3H 快
如图能表示反应历程的是__(填序号)。.

(5)一定温度下,IL恒容密闭容器中充人等物质的量的C3H6、NH3、O2制备丙烯腈,c(C3H6)与v正随时间变化的数据如下表:
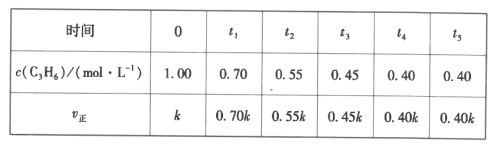
①判断t4时刻反应是否已经达到平衡状态并说明理由:__。
②列式并计算制备丙烯腈反应的平衡常数K=__(mol·L-1)-5。
③已知:正反应速率v正=kca(C3H6),根据表中数据,a=__。
【答案】+136 kJ/mol 高温 AB CO2与H2反应,降低H2的浓度,使C3H6的制备反应平衡正向移动,CO2与H2的反应是放热反应,使反应体系温度升高,C3H6的制备反应平衡正向移动 B t4时刻,正反应速率和C3H6的浓度均不再变化,则反应达到平衡 ![]() =
=![]() 1.41
1.41![]() 104 1
104 1
【解析】
Ⅰ.(1)根据键能计算可得;反应是吸热反应,且是熵增,根据△G=△H-T△S分析;
(2)反应吸热且气体分子数增加,提高丙烯产率需使平衡正向移动;
(3)体系中加入CO2使CO2(g)+H2(g)=CO(g)+H2O(g)正向移动,影响了H2浓度和体系温度,从这两方面进行分析;
Ⅱ.(4)第一步反应吸热,第二步放热,第一步反应慢,则活化能高;
(5)①观察反应速率,速率不变或浓度不变则达到了平衡,因此,t4时刻达到平衡
②根据“三段式”法进行计算;
③根据数据可知,v正是关于c(C3H6)的一次函数。
Ⅰ.(1)1个C3H8分子中有2个C-C键和8个C-H键,1个C3H6分子中有1个C-C键、1个C=C键和6个C-H键,1个H2分子中有1个H-H键,则制备丙烯反应的△H=(2![]() 346+8
346+8![]() 414-346-6
414-346-6![]() 414-602-436)kJ/mol=+136 kJ/mol;反应是吸热反应,且是熵增,根据△G=△H-T△S,因此高温有利;
414-602-436)kJ/mol=+136 kJ/mol;反应是吸热反应,且是熵增,根据△G=△H-T△S,因此高温有利;
(2)反应吸热且气体分子数增加,升温和减小压强可以使平衡正向移动,冲入H2会使平衡逆向移动,加入催化剂平衡不移动,故选AB;
(3)CO2与H2反应,降低H2的浓度,使C3H6的制备反应平衡正向移动,CO2与H2的反应是放热反应,使反应体系温度升高,C3H6的制备反应平衡正向移动;
Ⅱ.(4)第一步反应吸热,第二步放热,排除A,第一步反应慢,则活化能高,故选B;
(5)①观察反应速率,速率不变或浓度不变则达到了平衡,因此,t4时刻达到平衡;
②由表中数据可得:

K=![]() 1.41
1.41![]() 104;
104;
③根据数据可知,v正是关于c(C3H6)的一次函数,则a=l。

 考前必练系列答案
考前必练系列答案【题目】下列有关物质检验的实验结论正确的是( )
实验操作 | 现象 | 结论 | |
A | 某溶液中加入氯化钡溶液 | 生成白色沉淀 | 该溶液一定含有SO42- |
B | 某溶液中加入无色酚酞试液 | 溶液变红色 | 该溶液一定是碱溶液 |
C | 将某溶液做焰色反应 | 焰色呈黄色 | 该溶液一定含有Na+ |
D | 往某溶液中加入盐酸 | 产生无色气体 | 该溶液一定含有CO32- |
A.AB.BC.CD.D
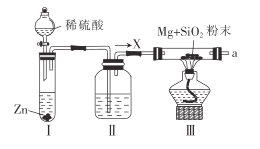
【题目】锰及其化合物在工农业生产和科技领域具有广泛的应用。
Ⅰ.溶液中的Mn2+可被酸性(NH4)2S2O8溶液氧化为MnO4-,同时(NH4)2S2O8被还原为SO42-,该方法可用于检验Mn2+。
(1)用酸性(NH4)2S2O8溶液检验Mn2+时的实验现象为____。
(2)该反应的离子方程式为____。
(3)已知H2S2O8中硫的化合价为+6,若硫酸的结构简式为![]() ,则H2S2O8的结构简式为____。
,则H2S2O8的结构简式为____。
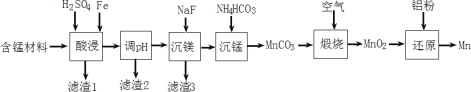
Ⅱ.实验室用含锰废料(主要成分为MnO2,还含有少量Al2O3、MgO、SiO2)为原料制备Mn的工艺流程如图所示。
已知:①部分难溶物的溶度积常数如下表所示。
难溶物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 | Mn(OH)2 |
溶度积常数 | 4.0×10-38 | 1.0×10-33 | 1.8×10-11 | 1.8×10-13 |
②当溶液中离子浓度≤1.0×10-5molL-1时,可认为该离子沉淀完全。
(1)“酸浸”时,MnO2将Fe氧化为Fe3+,该反应的离子方程式为____;该过程中浸出时间和液固比对锰浸出率的影响分别如图所示。
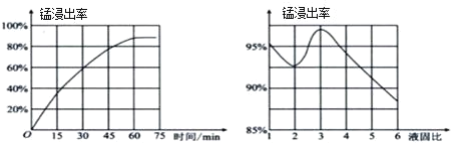
则适宜的浸出时间和液固比分别为____、____。
(2)若“酸浸”后所得滤液中c(Mn2+)=0.18molL-1,则应“调pH”的范围为____。
(3)“煅烧”反应中氧化剂与还原剂的物质的量之比为____。“还原”时发生的置换反应在化学上又叫作____。