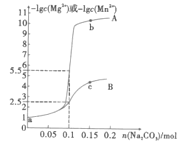
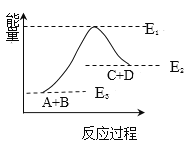
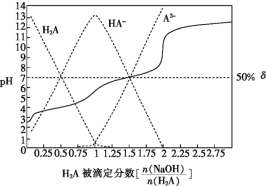
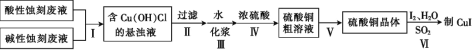
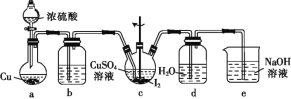
题目内容
【题目】已知A的产量通常用来衡量一个国家的石油化工水平,常用作水果催熟剂,现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示。
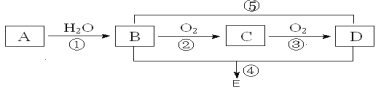
已知:醛可氧化生成羧酸。回答下列问题:
(1)写出下列物质的结构简式:A___;E___。
(2)写出下列反应的化学方程式,并注明反应类型:
①___、___;
②___、___;
④___、___;
(3)若想将B直接转化为D,可加入的物质为___。
【答案】CH2=CH2 CH3COOC2H5 CH2=CH2+H2O![]() CH3CH2OH 加成反应 2CH3CH2OH+O2
CH3CH2OH 加成反应 2CH3CH2OH+O2![]() 2CH3CHO+2H2O 氧化反应 CH3COOH+C2H5OH
2CH3CHO+2H2O 氧化反应 CH3COOH+C2H5OH![]() CH3COOC2H5+H2O 酯化反应 酸性高锰酸钾溶液
CH3COOC2H5+H2O 酯化反应 酸性高锰酸钾溶液
【解析】
A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,CH2=CH2与水发生加成反应生成B为CH3CH2OH,CH3CH2OH在Cu或Ag作催化剂条件下,发生催化氧化生成C为CH3CHO,CH3CHO进一步氧化生成D为CH3COOH,CH3CH2OH被酸性高锰酸钾溶液或酸性重铬酸钾溶液可以直接氧化生成CH3COOH,CH3COOH与CH3CH2OH发生酯化反应生成E为CH3COOC2H5,据此解答。
(1)A为乙烯,含有碳碳双键,结构简式为CH2=CH2,E为乙酸乙酯,结构简式为CH3COOC2H5;
(2)反应①是乙烯与水发生加成反应生成乙醇,反应方程式为:CH2=CH2+H2O![]() CH3CH2OH,反应②是乙醇氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2
CH3CH2OH,反应②是乙醇氧化反应生成乙醛,反应方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,反应④是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+C2H5OH
2CH3CHO+2H2O,反应④是乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(3)乙醇被酸性高锰酸钾溶液或酸性重铬酸钾溶液可以直接氧化生成乙酸。

 名校课堂系列答案
名校课堂系列答案【题目】二甲醚被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上常采用甲醇气相脱水法来获取。其反应方程式为:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
完成下列填空:
28、有机物分子中都含碳元素,写出碳原子最外层电子的轨道表示式_______________;
写出甲醇分子中官能团的电子式_________________。
29、碳与同主族的短周期元素相比,非金属性较强的是_________(填元素符号)。写出一个能证明你的结论的化学方程式_____________________________________。
30、在温度和体积不变的情况下,能说明反应已达到平衡状态的是______(选填编号)
a.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
b.容器内压强保持不变
c.H2O(g)浓度保持不变
d.气体平均相对分子质量保持不变
31、一定温度下,在三个体积约为2.0 L的恒容密闭容器中发生上述反应:
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.40 | 0.16 | 0.16 |
Ⅱ | 387 | 0.80 | a | |
Ⅲ | 207 | 0.40 | 0.18 | 0.18 |
(1)若要提高CH3OH的平衡转化率,可以采取的措施是______(选填编号)。
a.及时移走产物 b.升高温度 c.充入CH3OH d.降低温度
(2)I号容器内的反应经过t min达到平衡,则CH3OH的平均反应速率为_____________(用含t的式子表示)。II号容器中a =___________mol。
32、若起始时向容器I中充入CH3OH 0.2mol、CH3OCH3 0.30mol和H2O 0.20mol,则反应将向__________(填“正”“逆”)反应方向进行。