题目内容
19.中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化.回答下列问题:(1)中学化学实验中的中和热的测定所需的玻璃仪器有:烧杯、温度计、量筒、环形玻璃棒.在大小烧杯之间填满碎泡沫(或纸条)其作用是隔热、减少实验过程中热量的损失.
(2)该实验常用0.50mol•L-1 HCl和0.55mol•L-1的NaOH溶液各50mL.NaOH的浓度大于HCl的浓度作用是保证盐酸完全被中和.当室温低于10℃时进行,对实验结果会造成较大的误差,其原因是散热太快.
(3)若上述HCl、NaOH溶液的密度都近似为1g/cm3,中和后生成的溶液的比热容C=4.18J/(g•℃),则该中和反应放出热量为100×4.18×(t2-t1)×10-3kJ(填表达式),△H=-$\frac{100×4.18({t}_{2}-{t}_{1})×1{0}^{-3}}{0.025}$ kJ/mol(填表达式).
(4)中和热测定实验中,下列操作会使测得的△H数值偏大的是D
A.大烧杯上没有盖硬纸板
B.用环形铜丝搅拌棒代替环形玻璃搅拌棒
C.用相同浓度和体积的硝酸代替稀盐酸溶液进行实验
D.用1gNaOH固体代替50mL0.5mol/L的NaOH溶液进行实验.
分析 (1)根据量热计的构造和实验步骤来确定实验的仪器;中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失;
(2)为了保证HCl完全反应,碱应过量;温度过低,散热加快,对实验结过造成的误差较大;
(3)先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
(4)根据实验的关键是保温,如果装置能量散失,则会导致结果偏低,如果装置得到能量,则会导致结果偏高,
A.根据不盖硬纸板,会有一部分热量散失;
B.根据金属的导热性很好,会导致热量的散失;
C.根据相同浓度和体积的硝酸代替稀盐酸都是稀的强酸,对实验无影响;
D.NaOH固体溶于水放热,温度升高.
解答 解:(1)中和热测定的实验中,用到的玻璃仪器有大烧杯、小烧杯、温度计、量筒、环形玻璃搅拌棒;大小烧杯之间填满碎泡沫塑料的作用是:保温、隔热、减少实验过程中的热量散失,
故答案为:量筒;环形玻璃搅拌棒;隔热、减少实验过程中热量的损失;
(2)NaOH的浓度大于HCl的浓度,使盐酸完全被中和,减少了盐酸挥发对实验的影响;如果温度过低,散热加快,对实验结过造成的误差较大,
故答案为:保证盐酸完全被中和;散热太快;
(3)0.50mol•L-1HCl和0.55mol•L-1的NaOH溶液各50mL进行中和反应,生成水的物质的量为:0.05L×0.50mol•L-1=0.025mol,溶液的质量为:100ml×1g/ml=100g,设反应前后的温度值分别用t1和t2表示,温度变化的值△T=t2-t1,则生成0.025mol水放出的热量为Q=m•c•△T=100g×4.18J/(g•℃)×(t2-t1)=100×4.18×(t2-t1)×10-3kJ;
所以实验测得的中和热为:△H=-$\frac{100×4.18({t}_{2}-{t}_{1})×1{0}^{-3}}{0.025}$kJ/mol,
故答案为:100×4.18×(t2-t1)×10-3;-$\frac{100×4.18({t}_{2}-{t}_{1})×1{0}^{-3}}{0.025}$;
(4)A.不盖硬纸板,会有一部分热量散失,使测得的△H数值偏小,故A错误;
B.用环形铜丝搅拌棒代替环形玻璃搅拌棒,金属的导热性很好,会导致热量的散失,使测得的△H数值偏小,故B错误;
C.相同浓度和体积的硝酸代替稀盐酸都是稀的强酸,对实验无影响,使测得的△H数值不变,故C错误;
D.NaOH固体溶于水放热,温度升高,使测得的△H数值偏大,故D正确;
故答案为:D.
点评 本题考查热反应热的测定与计算,题目难度大,注意理解中和热的概念以及测定反应热的原理,明确常见化学实验的基本操作方法,试题培养了学生的分析能力及化学实验能力.

 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案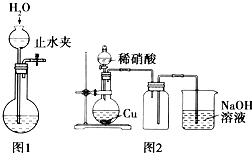
| A. | 用广泛pH试纸测得饱和氯水的pH约为2.2 | |
| B. | 用量筒量取7.60 mL 0.1 mol•L-1盐酸 | |
| C. | 用图1所示的操作可检查装置的气密性 | |
| D. | 实验室用图2所示的装置制取少量的NO |
| A. |  检查装置的气密性 | B. |  制取氨气 | ||
| C. |  进行石油分馏 | D. | 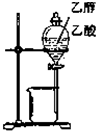 分离乙醇与乙酸 |
| A. | 溶解 加适量BaCl2溶液 过滤 | |
| B. | 溶解 加适量CaCl2溶液 过滤 | |
| C. | 溶解 加适量Ca(OH)2溶液 过滤 | |
| D. | 溶解 加适量盐酸 加热 |
下列说法正确的是( )
| A. | ①和②产物的阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物时,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | |
| D. | 反应:Na2O2(s)+2 Na(s)=2Na2O(s)△H=-317kJ/mol |
| A. | 钠着火用泡沫火器扑灭 | |
| B. | 苯酚沾在手上,应马上用NaOH溶液洗 | |
| C. | 皮肤上沾有浓硫酸,立即用量水冲洗 | |
| D. | 酒精灯在桌上歪倒失火后,立即用湿布盖上 |
 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题: .
.